東京大学大学院 農学生命科学研究科 プレスリリース
ビフィズス菌の効率的な代謝に関わる酵素の構造を解明した
- 発表者
- 鈴木 龍一郎 (東京大学大学院農学生命科学研究科 応用生命工学専攻 研究員(当時)
現職: 独立行政法人農業・食品産業技術総合研究機構 食品総合研究所 研究員)伏信 進矢 (東京大学大学院農学生命科学研究科 応用生命工学専攻 助教)
片山 高嶺 (石川県立大学 生物資源工学研究所 准教授)
Kim Byung-Jun (京都大学大学院生命科学研究科 統合生命科学専攻 修士課程学生(当時))
芦田 久 (京都大学大学院生命科学研究科 統合生命科学専攻 准教授)
山本 憲二 (京都大学大学院生命科学研究科 統合生命科学専攻 教授(当時)現職: 石川県立大学 生物資源工学研究所 教授)祥雲 弘文 (東京大学 名誉教授)
若木 高善 (東京大学大学院農学生命科学研究科 応用生命工学専攻 教授)
発表概要
ビフィズス菌は、高効率の特殊な解糖系(糖の代謝経路)を持つことが知られています。ビフィズス菌の特殊な解糖系の鍵となる酵素「ホスホケトラーゼ」の立体構造を解明しました。ホスホケトラーゼが触媒する、チアミン二リン酸(活性型ビタミンB1)を利用した脱水反応や、その結果生じる中間体にリン酸を付加してアセチルリン酸を生成する反応など、そのメカニズムの詳細が明らかになりました。
発表内容
ビフィズス菌はヒトの腸内細菌の中でも代表的な「善玉菌」として知られており、整腸作用の他にも腸管免疫賦活作用など、健康に有益な作用があることが報告されています。
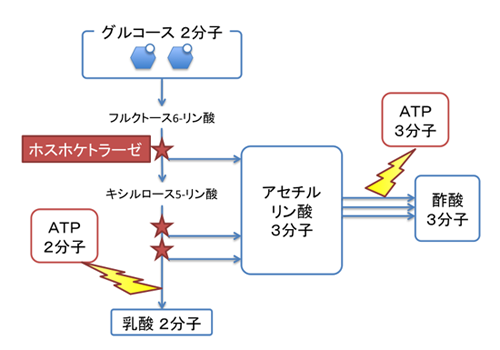
ビフィズス菌は酸素の少ない腸内に棲息する嫌気性細菌であり、おもに嫌気発酵によりエネルギーを得ています。ビフィズス菌は乳酸菌の一種であり、乳酸以外に酢酸なども産生するヘテロ乳酸菌(注1)に分類されます。ビフィズス菌は特殊な解糖系(注2)を持つことが古くから知られており、「ビフィドシャント(bifid shunt)」と呼ばれています。一般的な解糖系として有名な「エムデン-マイヤーホフ経路」ではグルコース1分子あたり2分子のアデノシン三リン酸(ATP:注3)が生成されますが、ビフィドシャントではグルコース2分子あたり5分子のATPが生成されるため、1.25倍効率が良いといえます(図1)。ビフィドシャントで中心的な役割を担う酵素が「ホスホケトラーゼ(注4)」です。ホスホケトラーゼは基質にリン酸を付加してアセチルリン酸を生成する反応を触媒しますが、このアセチルリン酸こそが、ATPおよび酢酸が生産されるもととなります。
ホスホケトラーゼが発見されたのは50年以上も前(1958年)のことですが、その立体構造はごく最近まで全く分かっていませんでした。本研究では、ホスホケトラーゼの立体構造をX線結晶構造解析(注5)の技術を用いて明らかにしました(図2)。さらに、反応中間体や、リン酸との複合体などの構造解析を通じて、この酵素のメカニズムを原子レベルで詳細に明らかにすることに成功しました。
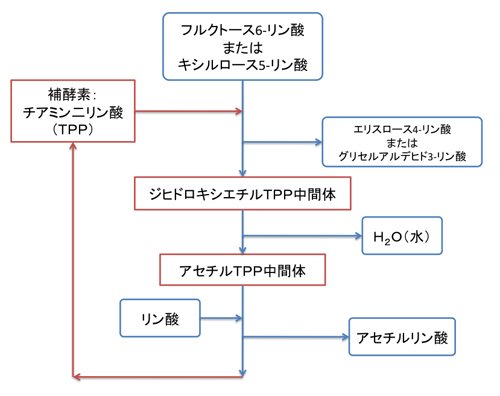
ホスホケトラーゼはチアミン二リン酸(TPP:注6)を補酵素とする酵素群の1種ですが、これまでに知られていたTPPを利用する酵素反応とは異なる新規な特徴が2つあります(図3)。
(1)「ジヒドロキシエチルTPP中間体」から脱水反応が起こり「アセチルTPP中間体」になる。
(2)「アセチルTPP中間体」にリン酸が付加してアセチルリン酸を生成する。
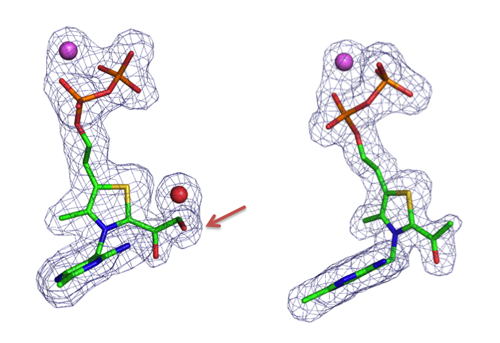
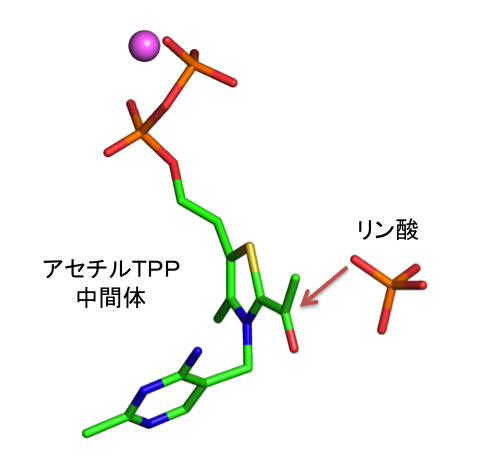
本研究では、「ジヒドロキシエチルTPP中間体」と「アセチルTPP中間体」の両方の構造をとらえることに成功し、脱水反応の詳細を明らかにしました(図4)。さらに、リン酸との複合体の構造を決定することにより、「アセチルTPP中間体」からアセチルリン酸が生成する反応の詳細も明らかにしました(図5)。
本研究では、代表的な善玉菌であるビフィズス菌が持つ効率的なエネルギー代謝のしくみを明らかにして、この菌が腸管の中で増殖する機構の一端を明らかにしました。さらに、TPPを利用した脱水反応という、これまでに知られていなかった酵素反応の詳細も明らかにしました。ビフィズス菌の持つ効率的な酵素を他の有用な微生物に導入して代謝の効率化をはかるなど、さまざまな応用が期待されます。
共同研究・助成など:本研究は、京都大学および石川県立大学と共同で行われました。X線回折データ測定には大学共同利用機関法人高エネルギー加速器研究機構 物質構造科学研究所 放射光科学研究施設 フォトンファクトリー(茨城県つくば市)および大型放射光施設SPring-8(兵庫県佐用郡佐用町)を用いました。本研究を含む一連の研究は生物系特定産業技術研究支援センター基礎研究推進事業の委託課題「酵素デザインを活用したミルクオリゴ糖の実用的生産技術の開発」によって行われたものです。
発表雑誌
(2010年8月24日電子版掲載、2010年10月29日刊行。)
Crystal Structures of Phosphoketolase: Thiamine Diphosphate-Dependent Dehydration Mechanism
Ryuichiro Suzuki, Takane Katayama, Byung-Jun Kim, Takayoshi Wakagi, Hirofumi Shoun, Hisashi Ashida, Kenji Yamamoto, Shinya Fushinobu
問い合わせ先
東京大学大学院農学生命科学研究科
応用生命工学専攻 酵素学研究室
助教 伏信 進矢
Tel: 03-5841-5151 or 03-5841-8227
FAX: 03-5841-5151
E-mail: asfushi@mail.ecc.u-tokyo.ac.jp
東京大学大学院農学生命科学研究科
応用生命工学専攻 酵素学研究室
教授 若木 高善
Tel: 03-5841-5152
FAX: 03-5841-5152
E-mail: atwakag@mail.ecc.u-tokyo.ac.jp
URL: http://enzyme13.bt.a.u-tokyo.ac.jp/
用語解説
代謝により乳酸を生産する細菌は乳酸菌と総称されるが、そのうち乳酸以外に酢酸やアルコールなどを同時に生産する細菌のこと。乳酸のみを生産する乳酸菌をホモ乳酸菌と呼ぶ。
注2 解糖系:グルコースをピルビン酸などの有機酸に分解する代謝経路。最も基本的な代謝系のひとつ。いくつかの種類があるが、エムデン-マイヤーホフ経路は最も一般的な解糖系として知られており、ほとんどの真核生物や嫌気性細菌ではこの経路が用いられている。乳酸菌では乳酸脱水素酵素のはたらきでピルビン酸を乳酸に変換している。
注3 アデノシン三リン酸:高エネルギーリン酸結合を持ち、「生体のエネルギー通貨」として数多くのエネルギー供給反応に関与する。細胞の働きに大切な「リン酸転移」という化学反応でも重要な役割を果たしている。
注4 ホスホケトラーゼ:キシルロース5-リン酸(またはフルクトース6-リン酸)とリン酸からグリセルアルデヒド3-リン酸(またはエリスロース4-リン酸)と水とアセチルリン酸を生成する反応を触媒する酵素(図3を参照)。乳酸菌、酵母、カビなど一部の微生物に存在するが、フルクトース6-リン酸を良好な基質とできるホスホケトラーゼはビフィズス菌にしか見いだされていない。
注5 X線結晶構造解析:酵素(タンパク質)の立体構造を得るための最も一般的な方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることが出来る。
注6 チアミン二リン酸 (TPP):チアミン(ビタミンB1)にリン酸が2個結合した活性型。補酵素としてはたらき、数多くの重要な代謝酵素の反応を助ける。ビタミンB1は1910年代に鈴木梅太郎が米ぬかから脚気を予防する因子として抽出し、オリザニンと命名したことで知られている。