東京大学 農学生命科学研究科 プレスリリース
2種類の化学反応を触媒する酵素が「変身」する姿を世界で初めてとらえた
- 発表者
- 伏信 進矢 (東京大学大学院農学生命科学研究科 応用生命工学専攻 准教授)
西増 弘志 (東京大学大学院理学系研究科 生物化学専攻 特任助教)
服部 大紀 (東京大学農学部 生命化学・工学専修 4年;当時)
宋 賢珍 (東京大学大学院農学生命科学研究科 応用生命工学専攻 博士課程2年)
若木 高善 (東京大学大学院農学生命科学研究科 応用生命工学専攻 教授)
発表概要
本研究科の若木高善(わかぎ たかよし)教授、伏信進矢(ふしのぶ しんや)准教授らと、本学大学院理学系研究科の西増弘志(にします ひろし)助教らの研究グループは、生命の起源に近いと考えられている超好熱性古細菌(ちょうこうねつせいこさいきん)の酵素が変身しながら2つの反応を触媒する様子を世界で初めて明らかにしました。
古細菌は変わった酵素をたくさんもっていますが、中でも特に不思議なのが「FBPアルドラーゼ/ホスファターゼ」です。この酵素は、2種類の異なる化学反応を触媒するという、生化学の常識では考えられない働きをします。またこの酵素は、生命進化の初期段階において必要不可欠な糖を生合成する反応を担います。
研究グループは、高エネルギー加速器研究機構(KEK)の放射光科学研究施設フォトンファクトリー(注1)を利用し、この酵素が大きく形を変えながら、2つの反応を触媒する様子をとらえることに成功しました。このような多機能酵素の働きは、生化学の常識を覆すものであり、今後他の生物でもこのような酵素が見つかることが期待されます。
発表内容

図1: 生物の進化系統樹の概略。超好熱菌を赤で示した。右側の枝を形成する「古細菌」と、「細菌」の枝の根元の近くに位置する超好熱菌がFBPA/Pを持つ。 (拡大画像↗)
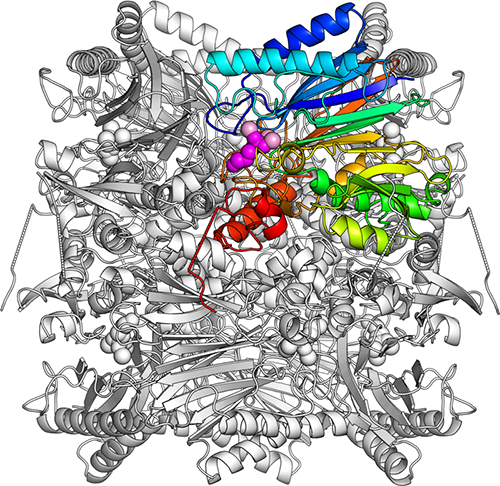
図2: FBPアルドラーゼ/ホスファターゼの全体構造。同じユニットが8個寄り集まって樽のような形になる。ひとつのユニットを虹色(青〜水色〜緑〜黄緑〜橙〜赤)で、結合した基質DHAPを紫色の球で、マグネシウムイオンをピンクの球で表した。 (拡大画像↗)
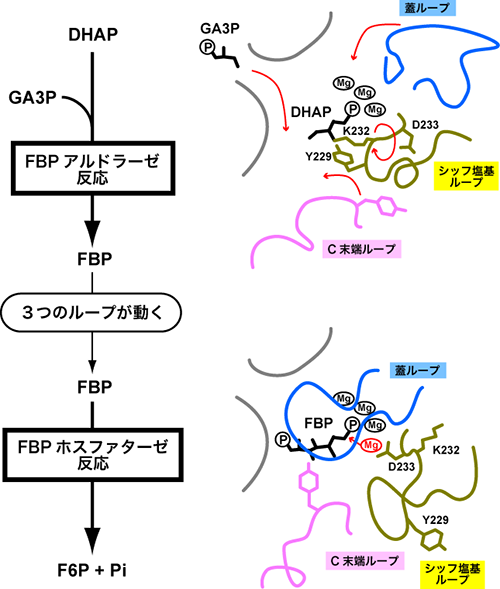
図3: FBPA/Pが触媒する反応(左側)と、反応が起こる部分の模式図(右側)。FBPアルドラーゼの状態(上側)とFBPホスファターゼの状態(下側)では3つのループの形が大きく異なる。 (拡大画像↗)
1. 研究の背景
超高温の熱水中で生育する微生物である「超好熱菌」は、生命がどのように進化してきたかを表す「進化系統樹」を描くと、根元の近くに位置するため、生命の共通の祖先に近いと考えられています(図1)。超好熱菌の多くは、一般的な生物(細菌や真核生物)とは異なる系統に属する生物群である「古細菌」に分類されます。超好熱性古細菌の中には、炭酸ガスのような簡単な無機物から、糖類などの複雑な化合物を合成して自分の細胞を作り上げることができる性質(独立栄養性)を示すものがあります。生物が糖を合成する反応経路(糖新生経路)は、原始的な生命が進化する際に重要であったと考えられます。
一般的な生物の場合、糖新生経路の途中の化学反応には、FBPアルドラーゼとFBPホスファターゼという2種類の別々の酵素が連続して関わっています。しかし、超好熱性古細菌などの糖新生経路では、これらの反応を1つのタンパク質が触媒します。この酵素はFBPアルドラーゼ/ホスファターゼ(FBPA/P)と呼ばれ、2種類の異なる化学反応を触媒することができる「一粒で二度おいしい」酵素です。
2. 研究内容と成果
研究グループは、大分県の別府温泉より単離された超好熱性古細菌Sulfolobus(スルホロバス)のもつFBPA/Pを用いて実験を行いました。FBPA/Pの立体構造は、8個の同じユニットが寄り集まった大きな樽(たる)のような形をしており、ユニットの間の部分で化学反応を触媒します(図2)。
FBPA/Pが触媒する2種類の反応は、具体的には、(1)ジヒドロキシアセトンリン酸(DHAP)とグリセルアルデヒド-3-リン酸(GA3P)を結合してフルクトース-1,6-ビスリン酸(FBP)を作るFBPアルドラーゼ反応と、(2)FBPをフルクトース6リン酸(F6P)と無機リン酸(Pi)に切断するFBPホスファターゼ反応です(図3左)。
研究グループは2004年に、後半のFBPホスファターゼ反応を触媒している途中の状態の立体構造(図3右下:FBPが結合している)を明らかにしていました。今回、前半のFBPA反応を触媒している途中の状態の立体構造(図3右上:DHAPが結合している)を、フォトンファクトリー(注1)PF-ARのNW12Aを利用し、X線結晶構造解析(注2)の技術を用いて、とらえることに成功しました。そして2つの状態を比べることにより、FBPA/Pがもつ1つしかない活性中心(化学反応を触媒する部分)で、3つのループ(蓋ループ、シッフ塩基ループ、C末端ループ)が大きく動くことにより、活性中心がまったく異なる形に変化することを明らかにしました。
FBPアルドラーゼの状態では、リジン残基(K232)が第一の基質であるDHAPと結合していました。第二の基質であるGA3Pが活性中心に入ってくると、すぐ近くにあるチロシン残基(Y229)のはたらきにより、GA3PとDHAPは結合してFBPができると考えられます(FBPアルドラーゼ反応)。FBPができるとリジン残基は自由になり、3つのループが動けるようになります。シッフ塩基ループがひっくり返って、蓋ループとC末端ループが閉じることにより、FBPホスファターゼの状態になります。すると、アスパラギン酸残基(D233)が活性中心に入って、マグネシウムイオンが結合できるようになります。このマグネシウムイオンの結合が引き金となり、FBPがF6PとPiに切断されます(FBPホスファターゼ反応)。
この「変身」こそが、まるで離れわざのように、2つの異なるしかし一連の反応を順次触媒する鍵であることが分かりました。このようなしくみは、1つの酵素は1つの反応を触媒すると信じられてきた生化学の常識を覆すものです。 現在の生物のほとんどはFBPA/Pをもっておらず、上記のように、2種類の別々の酵素でこれらの反応を触媒しています。原始的な生命は、FBPA/Pのような一人二役の酵素を利用して、今よりシンプルなやりかたで生合成を行っていたのかもしれません。
3. 今後の展開
今回の発見は、1つの酵素が2つの異なる化学反応を触媒するメカニズムを解明した初めての例であり、基礎科学的に重要な知見となります。さらに、今回の結果から、同様の多機能酵素が他にも存在する可能性が示されたことになります。今後、有用な化合物を簡単な化合物から一度に合成できる酵素が見つかることも期待されます。
参考URL:
東京大学大学院農学生命科学研究科 応用生命工学専攻 酵素学研究室ホームページ
http://enzyme13.bt.a.u-tokyo.ac.jp
新着論文レビュー
http://first.lifesciencedb.jp/archives/3444
発表雑誌
*共同筆頭著者,†責任著者
DOI:10.1038/nature10457
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 酵素学研究室
教授 若木高善(わかぎ たかよし)
TEL: 03-5841-5152
FAX: 03-5841-5152
E-mail: atwakag@mail.ecc.u-tokyo.ac.jp
URL: http://enzyme13.bt.a.u-tokyo.ac.jp/
東京大学大学院農学生命科学研究科 応用生命工学専攻 酵素学研究室
准教授 伏信進矢(ふしのぶ しんや)
TEL: 03-5841-5151, 03-5841-8227, or 080-3019-6715
FAX: 03-5841-5151
E-mail: asfushi@mail.ecc.u-tokyo.ac.jp
高エネルギー加速器研究機構 広報室
森田 洋平
TEL: 029-879-6047
FAX: 03-5841-5152
E-mail: press@kek.jp
用語解説
光(Photon)の工場(Factory)の愛称で親しまれているPFは日本初のX線を利用出来る放射光専用光源として1982年に完成しました。大学や研究機関が共同で利用実験するための施設(大学共同利用機関)としてKEKで運用され、年間約3千名を超える国内外の研究者が実験に訪れ、物質科学・生命科学の基礎から応用に至る世界最先端の研究成果を創出しています。
注2 X線結晶構造解析:酵素(タンパク質)の立体構造を得るための最も一般的な方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることが出来る。