脂肪細胞分化過程における脂肪滴表面タンパク質ペリリピンのエピジェネティックな発現誘導機構を解明
- 発表者
-
藤木克則 (東京大学分子細胞生物学研究所・エピゲノム疾患研究センター 日本学術振興会特別研究員)
篠田旭弘 (東京大学大学院農学生命科学研究科・応用生命科学専攻・食品生化学 博士課程(当時))
加納ふみ (東京大学大学院総合文化研究科・広域科学専攻 助教)
佐藤隆一郎 (東京大学大学院農学生命科学研究科・応用生命化学専攻・食品生化学 教授)
白髭克彦 (東京大学分子細胞生物学研究所・エピゲノム疾患研究センター 教授)
村田昌之 (東京大学大学院総合文化研究科・広域科学専攻 教授)
発表のポイント
- ◆どのような成果を出したのか
- 哺乳動物の脂肪細胞の分化を制御する核内受容体PPARγに、その結合配列の周辺でDNAの脱メチル化を引き起こす働きがあることを明らかにした。
- ◆新規性(何が新しいのか)
- このDNA脱メチルが、PPARγ複合体のポリADPリボシル化修飾によるTETタンパク質の誘因によって引き起こされることを示した。
- ◆社会的意義/将来の展望
- 脂肪細胞分化に伴う脂肪滴形成の分子機構を明らかにすることにより、抗肥満を目指した創薬、機能性食品創製が可能となる。
発表概要
東京大学大学院農学生命科学研究科・佐藤隆一郎教授らの研究グループは、これまでに脂肪細胞の分化過程において、脂肪滴表面タンパク質Perilipin1がPPARγ依存的に発現誘導される機構を明らかにしてきた (Arimura et al. J. Biol. Chem. 279, 10070, 2004)。今回、東京大学大学院総合文化研究科の村田昌之教授と藤木克則らとの共同研究により、その更なる分子機構を明らかにした。
生物はエピジェネティクスと総称される染色体の局所構造を変化させる機構を用いて、ゲノムDNAに含まれる膨大な遺伝情報のうち必要な遺伝子を活性化し、不要なものを不活性化している。この機構のひとつであるDNAのメチル化は近傍遺伝子の不活性化に働くことがこれまでに明らかにされていたが、遺伝子の活性化が必要とされた際にどのようにして脱メチル化すべき領域が決定されるのかは不明であった。
今回、哺乳動物細胞の脂肪細胞分化の過程に注目し、分化特異的な遺伝子の発現を制御しているPPARγタンパク質がその標的遺伝子を活性化する際に、標的遺伝子のPPARγ結合配列の周辺でDNAの脱メチル化を引き起こすことを発見した。またDNAの脱メチル化はTETタンパク質によるメチル化シトシンのヒドロキシル化を介することが知られているが、村田昌之教授らはさらに、このDNA脱メチルがPPARγ複合体のポリADPリボシル化修飾によるTETタンパク質の誘因によって引き起こされることを示した。
発表内容
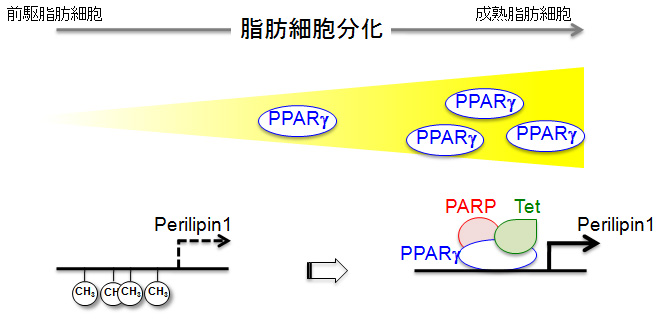
図1 脂肪細胞分化過程におけるPerilipin1プロモーター領域の脱メチル化による遺伝子発現制御機構の概略。前駆脂肪細胞にはPPARγ発現はほとんどなく、脂肪細胞分化に伴い発現量が上昇する。PPARγ複合体にはポリADPリボース合成酵素(PARP)が含まれ、これがTETタンパク質を誘引し、DNA脱メチル化を引き起こす。その結果として、脂肪滴表面タンパク質Perilipin1発現が上昇し、脂肪滴形成が盛んに行われるようになる。 (拡大画像↗)
哺乳動物の脂肪細胞の分化の過程は、その前駆細胞における脂肪細胞特異的な遺伝子の発現活性化によって引き起こされる。この過程において中心的な役割を果たすのが、配列依存的な転写因子として働く核内受容体、ペルオキシソーム増殖剤活性化受容体γ(PPARγ)である。PPARγは脂肪細胞分化の初期において数百に上る標的遺伝子の発現をリガンド依存的に誘導し、前駆脂肪細胞からの脂肪細胞分化を誘導する。PPARγは核内においてRXRという別の核内受容体とヘテロ二量体を形成してPPAR応答配列(PPRE)と呼ばれる特定のDNA配列に結合し、PPRE上に様々な遺伝子活性化補助因子と複合体を形成することにより下流の脂肪細胞特異的遺伝子の転写を活性化する。この遺伝子活性化補助因子には遺伝子のエピジェネティックな制御にかかわる分子も含まれており、発現に際しクロマチンの様々な制御を行うことが知られているが、DNAのメチル化(注1)の制御についてはこれまでには報告がなかった。
そこで今回、このPPARγ複合体による脂肪細胞特異的遺伝子のDNAの脱メチル化制御機構に注目して研究を行った。脂肪細胞特異的な遺伝子がもつPPRE周辺のDNAメチル化状態を、3T3-L1細胞(注2)の分化前後で比較したところ、分化前には高メチル化状態にあった各遺伝子のPPRE周辺のDNAが、分化後には脱メチル化している様子が観察された。そこでさらに、野生型PPREおよび変異を加えたPPREを持つPerilipin1遺伝子の発現制御領域のDNA配列を3T3-L1前駆脂肪細胞へ導入しメチル化状態を観察した結果、PPREの脱メチル化がPPARγのPPREへの直接的な結合によって引き起こされていることが示された。
最近の研究により、DNA脱メチル化にはTETタンパク質による5’メチルシトシン(5mC)の5’ヒドロキシメチルシトシン(5hmC)化とその後の塩基除去修復機構が作用していることが示唆されている。そこで、PPARγによるDNA脱メチル化におけるこれらのメカニズムの関与を検証した結果、3T3-L1の脂肪細胞分化の5~7日目において一過性の5hmCの増加が見られることがわかった。またこのとき、脱メチル化領域の周辺で5hmCが特異的に増加している様子が、抗5hmC抗体を用いたDNA免疫沈降により観察された。さらに、shRNAによるTETタンパク質のノックダウンは、この領域における5hmCの生成にはTETタンパク質が関与していることを示した。
脂肪細胞分化の過程はポリADPリボース合成酵素(PARP)の阻害剤によって抑制されることがこれまでの先行研究により知られている。ポリADPリボシル化(PAR化、注3)はDNAの複製や損傷に反応して起きるタンパク質修飾であり、DNA修復関連酵素などの損傷部位へのリクルートや周辺部位でのクロマチン構造の変化に関与しているとされている。また先行研究において、PARPがPPARγ複合体中に含まれ、その働きを調節していることも示されている。このPAR化のPPARγによる領域限定的な脱メチル化への影響をPARP阻害剤を用いて検証したところ、阻害剤濃度依存的な脱メチル化の抑制が引き起こされる様子が観察された。さらにPARPの阻害はPPARγによるPPRE周辺の5hmCの増加を妨げることも明らかとなった。また、TETタンパク質中に複数あるPAR結合モチーフはPAR鎖への結合能力を示した。すなわちこれらの結果から、PPARγ複合体中のPARPによるPAR化が、PPRE周辺のTETタンパク質による5hmC化に関与していることが示唆された(図1)。
DNAの脱メチル化を引き起こす刺激が加えられた際に、膨大な遺伝子の情報の中から標的となる遺伝子を選び出すという、エピジェネティックな変化の領域決定の過程がどのようになされるのかに関してはこれまでに報告がなかった。分化誘導に際して核内受容体PPARγがその結合配列PPREに結合することにより、PAR化を介した領域限定的な5mCの5hmC化によって脱メチル化領域を決定しているという今回の報告は、DNA脱メチル化の領域決定機構の解明の端緒となる重要な発見である。
発表雑誌
- 雑誌名
- 「Nature Communications」
(オンライン版:8月5日) 4巻. Article number: 2262.
- 論文タイトル
- PPARγ-Induced PARylation Promotes Local DNA Demethylation by Production of 5-Hydroxymethylcytosine
- 著者
- Katsunori Fujiki, Akihiro Shinoda, Fumi Kano, Ryuichiro Sato, Katsuhiko Shirahige, and Masayuki Murata
- DOI番号
- 10.1038/ncomms3262.
- アブストラクト
- http://www.nature.com/ncomms/2013/130805/ncomms3262/full/ncomms3262.html
問い合わせ先
東京大学大学院総合文化研究科広域科学専攻
教授 村田 昌之 (むらたまさゆき)
Tel: 03-5465-7625
Fax: 03-5454-6360
E-mail: mmurata [at mark] bio.c.u-tokyo.ac.jp
東京大学分子細胞生物学研究所エピゲノム疾患研究センター
日本学術振興会特別研究員 藤木 克則 (ふじきかつのり)
Tel: 03-5841-1450
Fax: 03-5841-0757
E-mail: katsu_f [at mark] iam.u-tokyo.ac.jp
東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学研究室
教授 佐藤 隆一郎 (さとうりゅういちろう)
Tel: 03-5841-5136
Fax: 03-5841-8029
E-mail: aroysato [at mark] mail.ecc.u-tokyo.ac.jp
用語解説
- (注1) DNAメチル化
- ゲノム中のCpG配列のシトシンでおこるDNA修飾。DNAのメチル化は一般的に近傍遺伝子の転写を抑制するように働く。
- (注2) 3T3-L1細胞
- マウスの脂肪細胞研究において広く用いられている細胞株。マウスの繊維芽細胞由来で、前駆脂肪細胞様の形質を示し、ホルモン刺激によって脂肪細胞様に分化する。
- (注3) ポリADPリボース
- NADを基質としてPARPによって被修飾タンパク質上で合成される変則的ポリヌクレオチドで、長いものでは~1000merほどにもなる。