旨味受容体T1R1/T1R3のアミノ酸選択性を決定する分子メカニズムの同定
- 発表者
-
戸田 安香(東京大学 大学院農学生命科学研究科 応用生命化学専攻・共同研究員)
中北 智哉(東京大学 大学院農学生命科学研究科 応用生命化学専攻・博士課程)
早川 卓志(京都大学 霊長類研究所 遺伝子情報分野・博士課程)
岡田 晋治(東京大学 大学院農学生命科学研究科 応用生命化学専攻・助教)
成川 真隆(東京大学 大学院農学生命科学研究科 応用生命化学専攻・特任助教)
今井 啓雄(京都大学 霊長類研究所 遺伝子情報分野・准教授)
石丸 喜朗(東京大学 大学院農学生命科学研究科 応用生命化学専攻・特任准教授)
三坂 巧(東京大学 大学院農学生命科学研究科 応用生命化学専攻・准教授)
発表のポイント
- ◆どのような成果を出したのか
- 旨味受容体T1R1/T1R3の受容するアミノ酸の種類がどのようなメカニズムで決定されるのかを明らかにしました。
- ◆新規性(何が新しいのか)
- ヒトがL-グルタミン酸に強い旨味を感じるしくみが明らかになりました。
- ◆社会的意義/将来の展望
- 霊長類がL-グルタミン酸に旨味を感じるようになった進化的・生理的意義を知るための糸口となることが期待されます。
発表概要
近年、甘味・旨味・苦味といった、基本味の受容に関わる味覚受容体が発見されました。旨味受容体については、2002年にT1R1/T1R3がL-アミノ酸の味を受容する分子として同定され、受容するアミノ酸の種類について動物種間で大きな差があることも明らかになっていました。ヒトT1R1/T1R3は私たちが強い旨味を感じるL-グルタミン酸によって強く活性化されますが、一方でマウスT1R1/T1R3はL-グルタミン酸に対する感度が悪く、L-アラニンやL-セリンなどの他の幅広いL-アミノ酸によって強く活性化されます。しかし、何故このような差が生じるのかについては、これまで明らかにされてきませんでした。
東京大学大学院農学生命科学研究科の三坂巧准教授らの研究グループは、ヒトとマウスのキメラ旨味受容体・点変異体を数多く作製し、そのアミノ酸応答パターンを詳細に調べることで、T1R1/T1R3のアミノ酸認識に重要な残基の同定を行いました。その結果、T1R1/T1R3の受容するアミノ酸の種類が、「アミノ酸結合部位におけるアミノ酸選択性」と「アミノ酸結合部位以外の領域で決定される受容体の活性の強さ」という2つの異なる因子の組み合わせで決定されることを明らかにしました。
発表内容
「旨味(umami)」は、昆布だしの主成分であるL-グルタミン酸がもたらす味であり、現在では、甘味・苦味・酸味・塩味と並ぶ基本五味の一つとして、国際的に認められております。旨味物質を受容する味覚受容体としては幾つかの候補分子が知られていますが、その中でT1R1/T1R3は、旨味感覚に特有な「アミノ酸と核酸との旨味相乗効果」を媒介する重要な受容体として機能しています。これまでの研究において、T1R1/T1R3が受け取るアミノ酸の種類には、動物種間で大きな差が認められることが明らかになってきました。ヒトT1R1/T1R3は私たちが旨味を感じるL-グルタミン酸によって強く活性化されるのに対し、マウスT1R1/T1R3はL-グルタミン酸に対する感度が悪く、一方でL-アラニンやL-セリンなどの他の幅広いL-アミノ酸によって強く活性化されます。今回の研究では、このような差がどのようなメカニズムによって生ずるのか、つまり、T1R1/T1R3が受容するアミノ酸の種類が何によって決定されるのかについて、その分子メカニズムを検証することにしました。
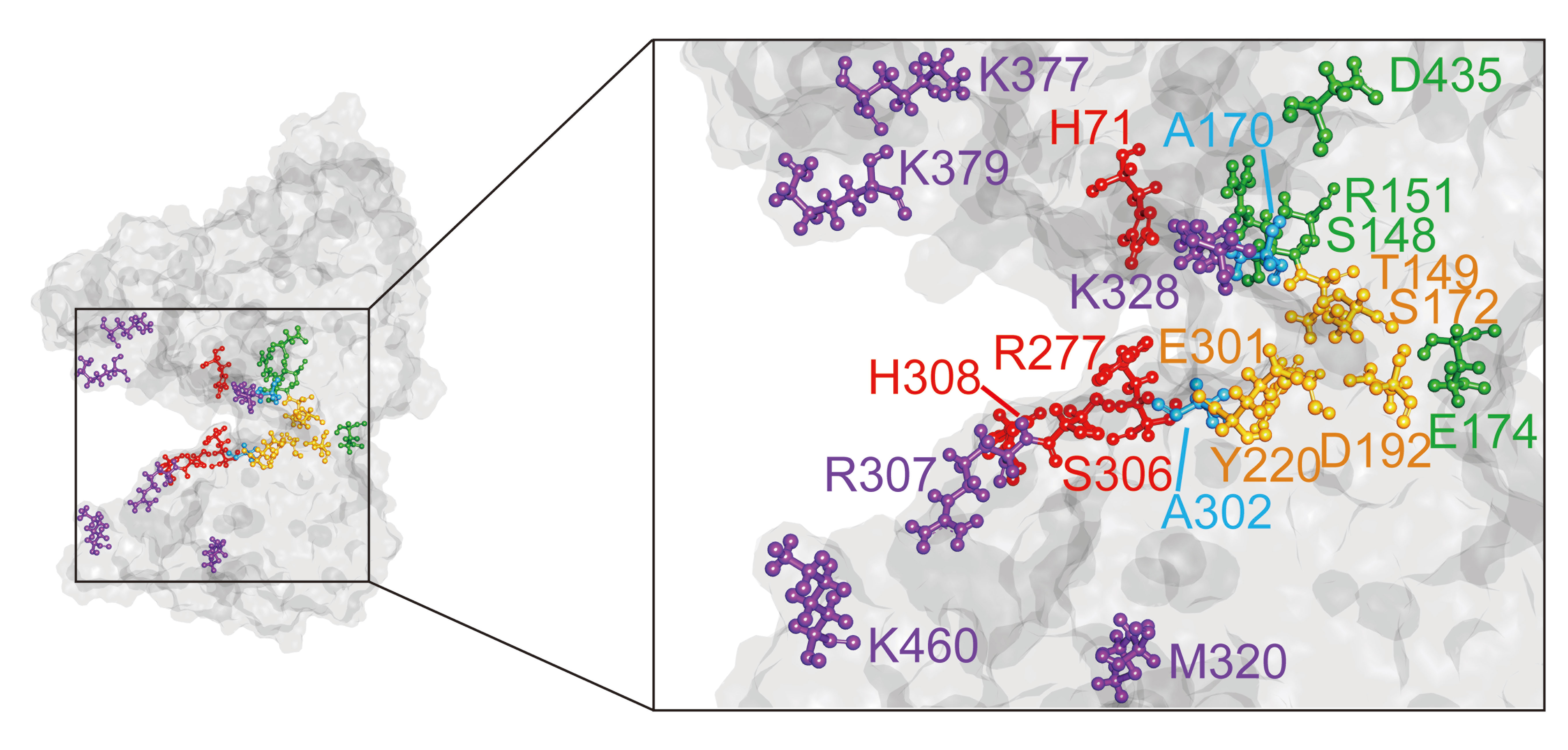
図1 旨味受容体のアミノ酸選択性に影響を与える残基の同定(拡大画像↗)
ヒト旨味受容体T1R1サブユニットの細胞外領域モデルにおいて、受容するアミノ酸の決定に強く寄与するアミノ酸残基をモデル上で表示した。緑色:ヒト型のL-グルタミン酸受容に重要な残基、紫色:マウス型の幅広いアミノ酸を受容するために重要な残基、黄色:既知のアミノ酸結合に重要な残基、赤色:既知の核酸結合に重要な残基。
ヒト型のL-グルタミン酸受容に重要な残基は、既知のアミノ酸結合部位の周辺に存在しているのに対し、マウス型の幅広いアミノ酸を受容するために重要な残基は、アミノ酸結合部位とは大きく離れた領域に存在している。
まず、多種類のヒト-マウスのキメラ受容体・点変異体におけるアミノ酸応答パターンを調べることで、ヒト型の「L-グルタミン酸受容に重要な残基」とマウス型の「幅広いアミノ酸を受容するために重要な残基」を同定することを試みました。その結果T1R1サブユニット内に、それぞれの機能に重要な6残基ずつを決定することに成功しました。これら12残基をT1R1の分子モデル上にマッピングすること(図1)で、マウス・ヒトT1R1/T1R3間でアミノ酸受容がどのように異なるかについて、以下のように考察してみました。
ヒト型の「L-グルタミン酸受容に重要な残基」は、T1R1サブユニットの細胞外領域に存在するアミノ酸結合部位近傍に位置していることが判明しました。特に、6残基中でL-グルタミン酸受容に最も決定的に影響を与える2つの残基は、分子モデルのアミノ酸結合部位内において上下対に存在していました。これらの2つの残基は、マウスT1R1では酸性アミノ酸残基であるのに対し、ヒトT1R1ではアラニン残基になっています。従って、マウスT1R1では、L-グルタミン酸結合時にこれらの酸性アミノ酸残基とL-グルタミン酸の側鎖のカルボキシル基との間で静電的な反発が生じることで、L-グルタミン酸活性が顕著に低下することが推察されました。一方でヒトT1R1は、これらの残基の負電荷が消失することに、より高いL-グルタミン酸活性を獲得したことが考えられました。
一方、マウス型の「幅広いアミノ酸を受容するために重要な残基」については、アミノ酸結合部位とは離れた領域に存在することが分かりました。すなわち、これらの残基はアミノ酸の結合に直接関与するのではなく、受容体全体の活性調節に寄与していることが推察されました。つまり、マウスT1R1/T1R3は受容体の活性がヒトと比べて高いため、多くのL-アミノ酸を受容することが可能になると考えられました。
以上の結果、T1R1/T1R3のアミノ酸認識が「アミノ酸結合部位におけるアミノ酸選択性(L-グルタミン酸の結合しやすさ)」と「アミノ酸結合部位以外の領域で決定される受容体の活性の強さ」という、2つの異なる因子の組み合わせで決定されるという仮説を提唱することができました。この仮説は、ヒト・マウス受容体のみならず、3種の非ヒト霊長類の受容体を用いた実験においても、その妥当性を支持することができました。
本研究によって、T1R1/T1R3のアミノ酸認識における決定因子が同定にされたことで、今後、霊長類がL-グルタミン酸に旨味を感じるようになった進化的・生理的意義が解明されることと期待されます。
尚、本研究は、京都大学霊長類研究所の共同利用・共同研究として実施されました。
発表雑誌
- 雑誌名
- 「The Journal of Biological Chemistry」 (Vol. 288, No. 52, pp. 36863–36877, 2013年12月27日掲載)
- 論文タイトル
- Two distinct determinants of ligand specificity in T1R1/T1R3 (the umami taste receptor)
- 著者
- Yasuka Toda, Tomoya Nakagita, Takashi Hayakawa, Shinji Okada, Masataka Narukawa, Hiroo Imai, Yoshiro Ishimaru, and Takumi Misaka
- DOI番号
- doi:10.1074/jbc.M113.494443
- アブストラクト
- http://www.jbc.org/content/288/52/36863.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 生物機能開発化学研究室
准教授 三坂 巧
Tel: 03-5841-8117
研究室URL: http://park.itc.u-tokyo.ac.jp/biofunc/