ハチドリが獲得した甘味受容システム - 旨味受容体の機能の転換 -
- 発表者
-
Maude W. Baldwin(Department of Organismic and Evolutionary Biology, Harvard University and the Museum of Comparative Zoology)
戸田 安香(東京大学大学院農学生命科学研究科 応用生命化学専攻 共同研究員)
中北 智哉(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士課程)
Mary J. O'Connell(Bioinformatics and Molecular Evolution Group, School of Biotechnology, Dublin City University)
Kirk C. Klasing(Department of Animal Science, University of California)
三坂 巧(東京大学大学院農学生命科学研究科 応用生命化学専攻 准教授)
Scott V. Edwards(Department of Organismic and Evolutionary Biology, Harvard University and the Museum of Comparative Zoology)
Stephen D. Liberles(Department of Cell Biology, Harvard Medical School)
発表のポイント
◆花の蜜を主食とするハチドリがどのように糖の味を感知しているのかを明らかにしました。
◆鳥類の祖先は甘味物質を感知するタンパク質を失ってしまいましたが、ハチドリはアミノ酸の味を認識するタンパク質の機能を変化させ、甘味物質を感知する能力を再び獲得したことが分かりました。
◆進化の過程で感覚受容のシステムが新しい感覚やそれに伴う新しい行動を獲得していく仕組みについて理解する上で一助になることが期待されます。
発表概要
動物の味覚や嗅覚などの感覚を受容するシステムは、新しい環境に適応して進化していくことがあります。例えば、鳥類は進化の過程で甘味物質を感知するセンサータンパク質(甘味受容体T1R2-T1R3)を失っていることが知られています。しかし、鳥類の中にはハチドリのように花の蜜を主食とするものもあり、甘味受容体のないハチドリがどのように糖の味を感知しているのかは、これまで分かっていませんでした。
そこで、東京大学大学院農学生命科学研究科の戸田安香研究員および三坂巧准教授らの研究グループは、ハーバード大学等と共同で鳥類の味覚受容体を解析し、脊椎動物において一般的に旨味物質を感知するセンサータンパク質(旨味受容体T1R1-T1R3)が、ハチドリにおいては甘味物質の受容体として機能していることを明らかにしました。更に、T1R1-T1R3が認識する甘味物質の特徴とハチドリが実際に嗜好性を示す味物質とが一致することを見出しました。
本成果から、ハチドリが近縁種である昆虫食のアマツバメから分岐した後に、旨味受容体の機能が変化して花の蜜を利用する能力を獲得し、この能力がハチドリの大規模な種の拡散に貢献したことが示唆されます。
発表内容
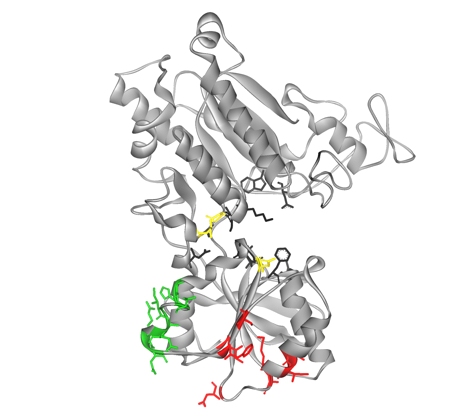
図1 ハチドリT1R3の細胞外領域の分子モデル
甘味物質の受容に寄与した19個のアミノ酸残基は黄色、緑色、赤色で示す3つの領域に分かれて存在していた。黒色のアミノ酸残基は、推定の味物質結合部位を示す。(拡大画像↗)

図2 ハチドリを用いた行動実験
ハチドリは水よりも糖や糖アルコールの溶液を好んで摂取した。 (撮影:Maude W. Baldwin)(拡大画像↗)
【研究の背景】
感覚を受容するシステムは環境に対して高い適応力があります。例えば、もはや生存に必須では無くなった感覚が失われることもあれば、逆に環境に適応するために新しい感覚を獲得することもあります。香気物質やフェロモン、味物質と結合するタンパク質(受容体)はその動物種の生息する環境に応じて、これまであった受容体群の種類を増やしたり減らしたり、もしくは全く新しい受容体を獲得するように進化してきました。
脊椎動物においては、甘味と旨味の感覚はGタンパク質共役型受容体(注1)であるT1Rと呼ばれる受容体で受け取られます。T1RにはT1R1、T1R2、T1R3の3種類の受容体が存在し、T1R1とT1R3の対(T1R1-T1R3)が旨味を、T1R2とT1R3の対(T1R2-T1R3)が甘味を受容します。ほとんどの脊椎動物はT1R1、T1R2、T1R3の3種類の受容体をもっていますが、肉食に特化したネコ科の動物では甘味受容体を構成するT1R2を失い、糖に対する嗜好性を失っていることが知られています。一方で、肉食から竹食に転向したジャイアントパンダは旨味受容体を構成するT1R1を失っていることが知られています。鳥類においても、ニワトリ、シチメンチョウ、錦花鳥(ゼブラフィンチ)において甘味受容体を構成するT1R2が欠損していることが報告されていますが、T1Rの種類と鳥類の生態の関係については明らかになっていませんでした。
鳥類の食物は果実、花の蜜、動物、昆虫、種子など多様性に富んでいます。その中でも、ハチドリは花蜜を主食としており、糖を豊富に含む花蜜を認識し利用する能力を獲得したことがハチドリの大規模な種の拡散を可能にしたのだと考えられています。しかし、どのようにしてハチドリが糖を感知しているのかについては未だ明らかになっていませんでした。
【研究内容】
東京大学大学院農学生命科学研究科の戸田安香研究員および三坂巧准教授らの研究グループは、ハーバード大学等と共同で鳥類の味覚受容体を解析し、ハチドリが糖を感知する仕組みを明らかにしました。
まず、異なる食性をもつ10種の鳥の全ゲノム配列からT1R遺伝子を探索しました。その結果、全ての鳥においてT1R1とT1R3をコードする遺伝子が見つかりました。更にハチドリのT1R1およびT1R3は正の選択(注2)を受けていると考えられるアミノ酸残基(注3)が複数見つかりました。一方で、糖への嗜好性がないニワトリや、ハチドリに最も近縁で昆虫食として知られるアマツバメでも同様の解析をしましたが、ニワトリやアマツバメのT1R1、T1R3には正の選択を受けていると推察されるアミノ酸残基はありませんでした。更に、全ての鳥類のゲノム配列中にT1R2遺伝子を見つけることはできませんでしたが、鳥類に最も近縁なワニ類を含む爬虫類はT1R2遺伝子を持っていたため、T1R2遺伝子の欠失は鳥類の祖先である恐竜で生じたものではないかと示唆されました。以上の結果から、花蜜や甘い果実を好む鳥には、甘味受容体T1R2-T1R3とは異なる糖の受容機構が存在すると推察されました。
甘味物質の受容体を同定するために、ハチドリ、ニワトリ、アマツバメの3種の味覚受容体について糖やアミノ酸に対する応答を調べました。その結果、ハチドリのT1R1-T1R3がスクロース、フルクトース、グルコースなどの糖に応答することが明らかになりました。ハチドリのT1R1-T1R3は人工甘味料であるスクラロースや糖アルコール(ソルビトール、エリスリトールなど)にも応答しましたが、シクラメート、アセスルファムK、アスパルテームなどの人工甘味料には応答しませんでした。一方で、ニワトリやアマツバメのT1R1-T1R3は甘味物質には応答せず、L-アラニンやL-セリンといったアミノ酸に応答しました。これまでに、霊長類、齧歯類、真骨魚類のT1R1-T1R3もアミノ酸に応答することが報告されており、T1R1-T1R3は嗜好性のアミノ酸を感知する受容体だと考えられています。これらの結果よりハチドリのT1R1-T1R3は4200‐7200万年におよぶ進化の過程で、甘味物質を受容する新しい機能を獲得したのだと示唆されました。
次に、ハチドリのT1R1-T1R3について、甘味物質への応答を可能にした決定的な変異を同定するために、甘味物質に応答するハチドリのT1R1-T1R3と甘味物質に応答しないニワトリのT1R1-T1R3を組み合わせた受容体(キメラ受容体)が糖やアミノ酸に対し応答するかどうかを調べました。その結果、ハチドリのT1R1-T1R3におけるT1R3の細胞外領域(全493アミノ酸残基)をニワトリのT1R3の細胞外領域に置き換えたキメラ受容体が甘味物質に応答しない一方で、アミノ酸に応答することが分かりました。そして、このニワトリのT1R3に置き換えた領域のうち19個のアミノ酸残基をハチドリのT1R3のアミノ酸残基に戻すと、再び甘味物質に応答するようになりました。よって、この19個のアミノ酸残基が甘味物質の受容に関与していることが明らかになりました。更に、この19個のアミノ酸残基の中には、前述の正の選択を受けていると推定されたアミノ酸残基が2つ含まれていました。受容体の機能解析によって、T1R3だけでなく、T1R1も甘味物質の受容に関わることが示されたことから、ハチドリのT1R1-T1R3が甘味物質に応答するようになったのには、T1R1とT1R3の両方に点在する複数の変異が寄与していると推察されました。
ハチドリのT1R3の分子モデルを作製し、甘味物質の受容に関与していることが明らかになった19個のアミノ酸残基がどの位置に存在しているのかを調べました。その結果、19個のアミノ酸残基は大きく3つの領域に分かれて存在していました(図1)。そのうち一つの領域は、味物質などとの結合に関わる部位だと示唆されました。一方で、その他の2つの領域は受容体におよぼす機能の知られていない部位に存在していました。ハチドリのT1R1-T1R3はT1R1とT1R3の両方に広がるさまざまな変異の結果、アミノ酸とは全く構造の異なる糖などの甘味物質の受容を可能にしたのだと推察されました。
続いて、T1R1-T1R3の機能が実際の味覚行動に影響を与えているのかを調べるために、二瓶選択法(注4)を用いてハチドリの嗜好性を調べました(図2)。その結果、T1R1-T1R3の応答と一致して、ハチドリはスクロース、フルクトース、グルコースなどの糖や糖アルコールを好み、一方で人工甘味料のアスパルテームやシクラメート、アセスルファムKは嗜好しませんでした。この結果から、T1R1-T1R3が認識する甘味物質の特徴とハチドリが実際に嗜好性を示す味物質とが一致することが明らかになりました。
【社会的意義・今後の予定】
本研究グループは鳥類における味覚受容体の調査とその機能解析を行い、動物の生態の多様性とその多様性の原因となる進化的イベントの分子基盤の一例を示しました。ハチドリは昆虫食であった祖先から分岐した後、味覚受容体の機能を変化させました。この味覚受容体の機能変化がハチドリに花蜜食という能力を獲得させ、ハチドリの種の拡大に貢献したのではないかと示唆されます。ネコなどの肉食哺乳類がT1R2を失ったのと同様に、肉食恐竜を由来とする鳥類の祖先はT1R2を失い、甘味受容体T1R2-T1R3を介して甘味を感じることができなくなりました。そのような背景の中で、ハチドリは長い時を経て甘味物質に対する新しい受容体を獲得し、再び甘味物質を感知する能力を獲得したというシナリオが示唆されます。本成果は、進化の過程で感覚受容のシステムが新しい感覚やそれに伴う新しい行動を獲得していく仕組みについて理解する上で一助になることが期待されます。
発表雑誌
- 雑誌名
- 「Science」(2014年8月22日号)Vol. 345, pp. 929-933
- 論文タイトル
- Evolution of sweet taste perception in hummingbirds by transformation of the ancestral umami receptor
- 著者
- Maude W. Baldwin# *, Yasuka Toda#, Tomoya Nakagita, Mary J. O'Connell, Kirk C. Klasing, Takumi Misaka, Scott V. Edwards, Stephen D. Liberles*.
#These authors contributed equally to this work
*Corresponding authors - DOI番号
- 10.1126/science.1255097
- 論文URL
- http://www.sciencemag.org/content/345/6199/929.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 生物機能開発化学研究室
准教授 三坂 巧 (みさか たくみ)
Tel:03-5841-8117
研究室URL:http://park.itc.u-tokyo.ac.jp/biofunc/
用語解説
- 注1 Gタンパク質共役型受容体
- 味物質、香気成分、光などの外来刺激や神経伝達物質、ホルモンなどを感知する膜タンパク質。細胞膜を7回貫通する特徴的な構造を有する。Gタンパク質と呼ばれるタンパク質を介して細胞内にシグナルを伝達する。
- 注2 正の選択
- ある突然変異をもつ個体がそれを持たない個体に比べて生存力や子孫を残す能力で勝っていた場合、集団内にその変異がより広く伝わるようになること。
- 注3 アミノ酸残基
- ペプチドやタンパク質を構成するアミノ酸構造。
- 注4 二瓶選択法
- 行動実験の一つ。2つの味溶液を呈示し、その飲水量や舐める回数を比較することでどちらの味溶液を好むかを明らかにする方法。