新たな細胞内脂質代謝制御機構の発見 - 細胞内小胞輸送による制御機構の解明 -
- 発表者
-
高島 皓平(京都大学大学院薬学研究科 生体情報制御学分野)
齋藤 明奈(京都大学大学院薬学研究科 生体情報制御学分野)
船橋 輝記(京都大学大学院薬学研究科 生体情報制御学分野)
廣瀬 祥平(京都大学大学院薬学研究科 生体情報制御学分野)
八木 智佳子(京都大学大学院薬学研究科 生体情報制御学分野)
野崎 梢平(京都大学大学院薬学研究科 生体情報制御学分野)
佐藤 隆一郎(東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学 教授)
申 惠媛(京都大学大学院薬学研究科 生体情報制御学分野 准教授)
中山 和久(京都大学大学院薬学研究科 生体情報制御学分野 教授)
発表のポイント
◆細胞内小胞輸送(注1)と脂質合成制御の新たな接点を明らかにすることに成功しました。
◆SREBP-SCAP二量体(注2)が恒常的に小胞体からゴルジ装置へ輸送され、その後再び小胞体へと戻る巡回経路の存在が新たに示唆されました。
◆メタボリックシンドローム等の疾患の元凶ともいえるSREBP-1cの過剰な活性化を抑制する創薬、機能性食品創製に向けて有用な知見となる事が期待されます。
発表概要
転写因子SREBP(sterol regulatory element-binding protein)は脂肪酸・トリグリセリド合成、コレステロール合成に関与する酵素遺伝子群の発現を調節するタンパク質として、脂質代謝制御の中心的役割を担っています。SREBPは、合成直後は2カ所の膜貫通領域を介して小胞体膜タンパク質として、同じく膜タンパク質のSCAP(SREBP cleavage-activating protein)と二量体を形成して膜上に留まる特徴を持ちます。小胞体膜中のコレステロール含有量が低い時にはこれを感知し、SREBP-SCAP二量体はCOPII小胞へと移動し、小胞を介してゴルジ装置へと輸送されます。ゴルジ装置には切断酵素(注3)が待ち受けており、細胞質側の部位が切り出され(活性型)、これが核へと輸送され、核内でLDL受容体遺伝子を初めとする応答遺伝子群の転写を促進する働きを発揮します。
このようにCOPII小胞を介した小胞体からゴルジ装置への輸送が厳密に制御されるという定説とは異なり、かなりの量のSREBP-SCAP二量体は小胞体からゴルジ装置へ輸送された後に、切断酵素による切断を受けずに小胞体へと逆輸送されるシステムが働いている事が、今回の研究により明らかにされました。小胞体-ゴルジ装置で生じるSREBPの活性化は、脂質代謝制御の根幹を成すものであり、その詳細なメカニズムを理解することは代謝恒常性維持に向けて重要なことと言えます。
発表内容
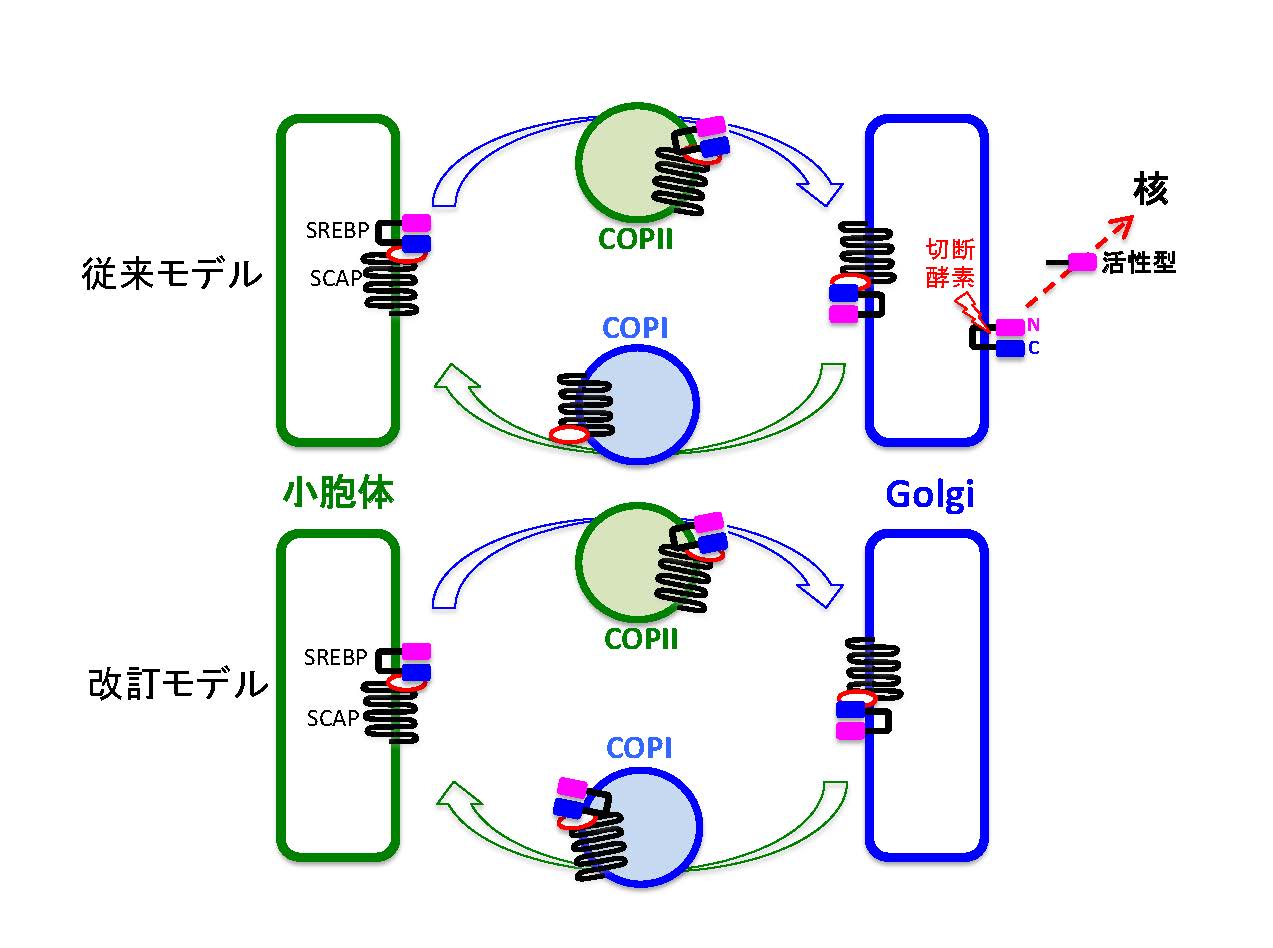
図1 SREBP-SCAP二量体の小胞体-ゴルジ装置間輸送の改訂モデル
従来モデル:SREBP-SCAP二量体はCOPII小胞を介してゴルジ装置へと輸送されると、切断酵素による切断を受け、N末端領域からなる活性型が核へと輸送され、核内で転写因子として機能します。一方、SCAPはCOPI小胞により小胞体へと逆輸送され再利用されます。
改訂モデル:SREBP-SCAP二量体は、COPII小胞、COPI小胞を介して恒常的に小胞体-ゴルジ装置間を巡回輸送されます。COPI小胞輸送を阻害するとゴルジ装置に留まったSREBPは切断酵素による切断を受け、その結果、脂質合成遺伝子群の発現が上昇し、細胞内脂質が増加する現象が見られます。
つまり、従来モデルのようなCOPII小胞を介した輸送が活性型生成を決定するという単純なシステムではないことが、改訂モデルで示されました。(拡大画像↗)
細胞内の小胞体で合成されたタンパク質は、COPII小胞とよばれる小胞によりゴルジ装置へと輸送され、そこでさらに糖鎖の修飾などを受けます。この小胞輸送は一方向のものではなく、ゴルジ装置からはCOPI小胞が形成され、ある種のタンパク質は再び小胞体へと戻ります。
京都大学大学院薬学研究科・中山和久教授と東京大学大学院農学生命科学研究科・佐藤隆一郎教授のグループは、COPI小胞輸送を阻害すると、細胞内の脂肪蓄積が増加し、脂肪滴のサイズが大きくなる現象を見出し、詳細な細胞生物学的解析により、ゴルジ装置に残留した転写因子SREBPがプロセシングを受け、活性型になり脂肪合成遺伝子発現を上昇させることに起因することを明らかにしました。
つまり、かなりの量のSREBP-SCAP二量体は恒常的に小胞体からゴルジ装置へと輸送され、一部のSREBPはプロセシングを受けずに二量体のままCOPI小胞に組み込まれ、再び小胞体へと戻る巡回輸送経路の作動していることが明らかにされました(図1参照)。SREBPには脂肪酸・トリグリセリド代謝制御に深く関与するSREBP-1と、コレステロール代謝制御に関わるSREBP-2が存在し、いずれもSCAPと複合体を形成し、ゴルジ装置にたどり着いたのちに活性化されます。メタボリックシンドロームを初めとする複数の代謝異常疾患では、肝臓においてSREBP-1が過剰に活性化されることが引き金となると考えられています。
このような過剰な活性化を制御するために、小胞体-ゴルジ装置間における小胞輸送と脂質代謝制御の接点を明らかにした本知見は有用な情報として活用されることが期待されます。
発表雑誌
- 雑誌名
- 「Journal of Cell Science」
- 論文タイトル
- COPI-mediated retrieval of SCAP is critical for regulating lipogenesis under basal and sterol-deficient conditions
- 著者
- Kouhei Takashima, Akina Saitoh, Teruki Funabashi, Shohei Hirose, Chikako Yagi, Shohei Nozaki, Ryuichiro Sato, Hye-Won Shin and Kazuhisa Nakayama
- DOI番号
- 10.1242/jcs.164137
- 論文URL
- http://jcs.biologists.org/content/early/2015/06/16/jcs.164137.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学研究室
教授 佐藤 隆一郎
Tel:03-5841-5136
Fax:03-5841-8029
研究室URL:http://webpark1213.sakura.ne.jp/
用語解説
- 注1 細胞内小胞輸送
- 小胞体で合成されたタンパク質の多くはCOPII小胞を介してゴルジ装置へと輸送され、ゴルジ装置において糖鎖の修飾、タンパク質切断を介したプロセシングなどを受けます。更に細胞表面へと輸送されるタンパク質とは異なり、一部のタンパク質はCOPI小胞を介して再び小胞体へと戻ります。それぞれの小胞表面には特異的なタンパク質が複数結合し、その小胞の到達先を決定します。
- 注2 SREBP-SCAP二量体
- 転写因子SREBPは2か所の膜貫通領域を介して小胞体膜上に局在します。この際にC末端側領域が、結合タンパク質であるSCAPのC末端側領域と直接結合し、二量体を形成します。コレステロールが過剰状況下では、SCAPがさらに小胞体膜タンパク質のINSIGと結合し三量体を形成し、小胞体膜上に留まります。コレステロール量の減少に伴い、INSIGとの結合が弱まり、SREBP-SCAP二量体はCOPII小胞へと引き込まれ、やがてゴルジ装置へと輸送され、そこで切断酵素による切断を受けて活性型へと変換されます。
- 注3 切断酵素
- ゴルジ装置にはSREBPを2か所で切断する2種類の切断酵素(S1PとS2P)が待ち受けています。これら酵素によりN末端側約500アミノ酸を含む活性型が切断され、活性型SREBPは核へと輸送され、そこで初めて転写因子として応答遺伝子の発現促進作用を発揮します。