キラルアミン合成に有用なR体選択的アミントランスアミナーゼの基質特異性を改変する標的部位を同定
- 発表者
-
管立 軍(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任研究員)
宮川 拓也(東京大学大学院農学生命科学研究科 応用生命化学専攻 助教)
伊藤 紀幸(株式会社カネカ バイオテクノロジー開発研究所 )
八十原 良彦(株式会社カネカ バイオテクノロジー開発研究所 )
田之倉 優(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
発表のポイント
◆R体選択的アミントランスアミナーゼAb-R-ATAの立体構造を決定し、基質認識機構および基質特異性を明らかにしました。
◆Ab-R-ATAの改変型酵素の立体構造から基質特異性を改変するための標的部位を同定しました。
◆本研究で得られた構造情報は、有用なキラルアミン合成に利用可能な酵素のデザインに応用が期待されます。
発表概要
キラルアミンは、医薬、農薬、他の産業上有用な化合物の合成に欠かせない構成要素として利用されています。化学触媒法と比べて環境にやさしく、高効率にキラルアミンを合成するためのツールとして、アミントランスアミナーゼ(ATA)が注目されています。特にR体選択的なATA(R-ATA)は利用価値が高く、様々なR体アミンをもつ化合物の合成に応用が期待されています。
東京大学大学院農学生命科学研究科の田之倉優教授らの研究グループは、株式会社カネカ バイオテクノロジー開発研究所との共同研究により、Arthrobacter sp. KNK168由来R-ATA(Ab-R-ATA)の立体構造をX線結晶解析により決定し、その基質認識機構および基質特異性を規定する構造基盤を解明しました。さらに、先行研究において基質特異性が改変された、経口血糖降下薬sitagliptin合成に使われる酵素(ATA-117-Rd11)等の結晶構造の解析にも成功し、ATA-117-Rd11におけるアミノ酸残基の置換が基質特異性を変化させる仕組みを明らかにしました。本研究で得られた知見は、多様なキラルアミン化合物を創製するための新しい触媒の開発に貢献します。
発表内容
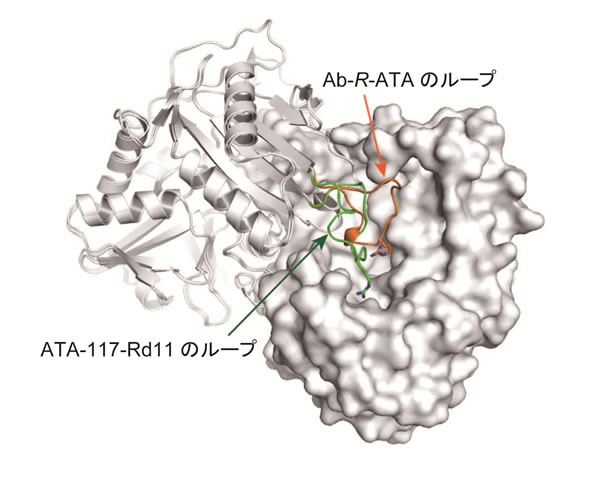
図1 Ab-R-ATAとATA-117-Rd11におけるループの構造変化(拡大画像↗)
医薬品等の開発において、特異的な生理活性の観点から特定のキラリティをもつ光学活性体の利用は不可欠であり、その需要は年々高まっています。光学活性体の一つであるキラルアミンは、医薬、農薬、他の産業上有用な化合物の合成に欠かせない構成要素として幅広く利用されています。化学触媒法と比べて環境にやさしく、高効率にキラルアミンを合成するためのツールとして、アミントランスアミナーゼ(ATA)が期待されています。特にR体選択的なATA(R-ATA)は利用価値が高く、2010年に米国Codexis社とMerck社は経口血糖降下薬sitagliptinの合成に適用できるよう、既存のR-ATAを酵素改変することに成功しました(ATA-117-Rd11)。これにより、光学純度99.95%を達成し、従来の化学触媒法と比べて、最終収率は10~13%増加し、一日当たりの生産力は53%増加しました。また19%の製造コストの削減にもつながっています。この例が示すように、R-ATAの基質特異性を規定する仕組みを理解することは、触媒としてのR-ATAの利用可能性を広げ、効率的なR体キラルアミン化合物の生産技術の開発に貢献します。
東京大学大学院農学生命科学研究科の田之倉優教授らの研究グループは、株式会社カネカ バイオテクノロジー開発研究所と共同で、Arthrobacter sp. KNK168由来R-ATA(Ab-R-ATA)の結晶構造を決定し、基質の認識に重要な構造基盤を明らかにしました。また、変異体解析と分子動力学(Molecular Dynamics, MD)シミュレーション(注1)により、活性部位にあるArg138が二重の基質認識(Dual substrate recognition)(注2)に機能することが示しました。さらに、先行研究において開発された改変体ATA-117-Rd11の結晶構造を決定してAb-R-ATAと構造造比較することにより、129番目から146番目までのアミノ酸残基が形成するループに大きな構造変化を見出しました(図1)。この構造変化がループ上のGly136の置換によって引き起こされることが、G136F変異体の結晶構造と活性測定によって示され、ループの構造変化によって基質特異性の改変を説明することに成功しました。これは、本研究で見出されたループがR-RTAの基質選択性を改変するための標的領域となり得ることを示しています。
本研究は、多様なキラルアミン化合物を創製するための新しい触媒の開発に貢献する構造情報を提供し、R-ATAを生体触媒として用いたキラルアミン合成への応用に貢献するものと期待されます。
本研究は、文部科学省「ターゲットタンパク研究プログラム」の支援を受けて行われました。
発表雑誌
- 雑誌名
- 「Scientific Reports」
- 論文タイトル
- A new target region for changing the substrate specificity of amine transaminases
- 著者
- Li-Jun Guan, Jun Ohtsuka, Masahiko Okai, Takuya Miyakawa, Tomoko Mase, Yuehua Zhi, Feng Hou, Noriyuki Ito, Akira Iwasaki, Yoshihiko Yasohara & Masaru Tanokura.
- DOI番号
- 10.1038/srep10753
- 論文URL
- http://www.nature.com/srep/2015/150601/srep10753/full/srep10753.html
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生物構造学研究室
教授 田之倉 優
Tel:03-5841-5165
研究室URL:http://fesb.ch.a.u-tokyo.ac.jp/
用語解説
- 注1 分子動力学(Molecular Dynamics, MD)シミュレーション
- 古典力学に基づき、物質を構成する分子や原子の動的な構造をコンピュータシミュレーションにより推測する手法である。生体高分子の動的な構造変化を理解するためによく使われている。
- 注2 二重の基質認識(Dual substrate recognition)
- アミントランスアミナーゼは、アミン化合物とケトン化合物との間でアミノ基転移反応を触媒する酵素であり、同じ活性部位で2種類の基質を認識する。