中性子回折法によってタンパク質の多彩さ・巧妙さを可視化することに成功
- 立体反転型セルラーゼは「かちかち玉」のような反応機構だった -
- 発表者
-
中村 彰彦(東京大学大学院農学生命科学研究科 生物材料科学専攻 特別研究員(研究当時)、現自然科学研究機構 岡崎統合バイオサイエンスセンター 分子科学研究所 助教)
石田 卓也(東京大学大学院農学生命科学研究科 生物材料科学専攻 特任助教)
日下 勝弘(茨城大学 フロンティア応用原子科学研究センター 産学官連携准教授)
山田 太郎(茨城大学 フロンティア応用原子科学研究センター 産学官連携准教授)
伏信 進矢(東京大学大学院農学生命科学研究科 応用生命工学専攻 教授)
田中 伊知朗(茨城大学工学部 生体分子機能工学科 教授)
金子 哲(琉球大学農学部 亜熱帯生物資源科学科 教授)
太田 和敬(宇宙航空研究開発機構有人宇宙技術部門きぼう利用センター 主任開発員)
田仲 広明((株)コンフォーカルサイエンス 代表取締役)
伊中 浩治((株)丸和栄養食品 代表取締役)
樋口 芳樹(兵庫県立大学大学院生命理学研究科 生命科学専攻 教授)
新村 信雄(茨城大学工学部 生体分子機能工学科 特命研究員)
鮫島 正浩(東京大学大学院農学生命科学研究科 生物材料科学専攻 教授)
五十嵐 圭日子(東京大学大学院農学生命科学研究科 生物材料科学専攻 准教授)
発表のポイント
◆茨城県生命物質構造解析装置(iBIX)の中性子線源を利用することにより、「活性中心がないのに活性がある」という不思議な特徴を持つセルロース分解酵素PcCel45Aの構造解析に世界で初めて成功し、その酵素反応メカニズムを明らかにしました。
◆本酵素は、酵素反応に重要なアミノ酸を通常とは異なる「イミド酸型」という特殊な状態にすることで酵素反応を行っており、そのアミノ酸付近で水素原子が「かちかち玉」のように移動して酵素反応が繰り返されることが新たにわかりました。
◆本研究で用いた構造解析手法により、タンパク質の多彩さ・巧妙さが可視化できることが明らかになりました。様々なタンパク質中でも同様の酵素反応が起こっている可能性があるため、この知見はバイオマス変換酵素の理解に留まらず、コンピュータを利用した医薬品デザイン技術にも波及する革新的な知見となります。
発表概要
化石資源の枯渇が危ぶまれる中、木や草のようなバイオマスを効率良く分解し様々な物質に変換する技術の開発が望まれています。
東京大学大学院農学生命科学研究科の五十嵐圭日子(きよひこ)准教授のグループは、茨城大学、宇宙航空研究開発機構(JAXA)、琉球大学、(株)コンフォーカルサイエンス、(株)丸和栄養食品、兵庫県立大学、茨城県との共同研究で、大強度陽子加速器施設(J-PARC)の物質・生命科学実験施設(MLF)内にある茨城県生命物質構造解析装置(iBIX)を用いて、きのこが生産する酵素セルラーゼ(PcCel45A)の中性子を用いた構造解析に成功しました。その結果、本酵素は酵素反応に重要なアミノ酸を「イミド酸型」という特殊な状態にすることで酵素反応を行っていることが分かりました。更にその重要なアミノ酸付近で水素原子が「かちかち玉」のように移動し、酵素反応が繰り返されるメカニズムを明らかにしました。
本研究から、中性子回折法(注1)によってタンパク質の多彩さ・巧妙さが可視化できることが明らかとなりましたが、様々なタンパク質中で同様な現象が起こっている可能性があるため、この知見はバイオマス変換酵素の理解に留まらず、コンピュータによる医薬品デザイン技術にも波及する革新的な知見となります。
発表内容
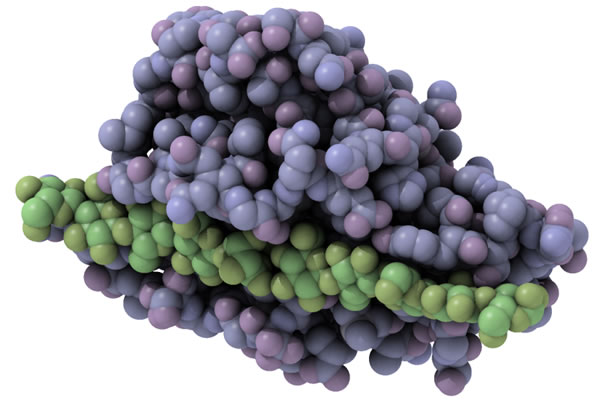
図1 きのこの一種であるPhanerochaete chrysosporiumがセルロースを分解するために生産するセルラーゼPcCel45Aの分子構造。図中で、紫色の部分が酵素(PcCel45A)、緑色の部分がセルロースの分子を表している。酵素がセルロースをきれいに取り込んでいる。(拡大画像↗)
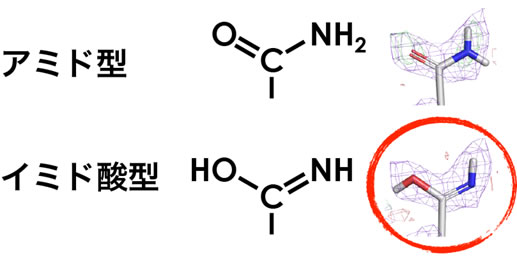
図2 PcCel45Aの92番目アスパラギン側鎖の拡大図。中性子散乱密度(紫:2Fobs-Fcalc(1σ)、緑:Fobs-Fcalc(2.0σ))に合わせて炭素(C)、水素(H)、酸素(O)および窒素(N)原子をモデリングしてみると、イミド酸型の方がきちんとそれぞれの原子が収まることが分かる。(拡大画像↗)
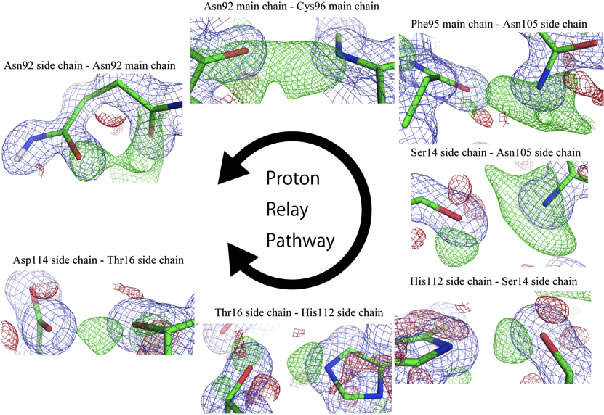
図3 PcCel45Aにおける活性残基周辺の水素イオンネットワーク。活性残基の一つ(一般塩基性触媒残基)である92番目アスパラギン(Asn92)から、96番目システイン(Cys96)と95番目フェニルアラニン(Phe95)、105番目アスパラギン(Asn105)、14番目セリン(Ser14)、112番目ヒスチジン(His112)、16番目スレオニンを経て(Thr16)、最後にもう一つの活性残基(一般酸性触媒残基)である114番目アスパラギン酸(Asp114)までが水素(図中緑色の編み目)が繋がって「Proton Relay Pathway」を形成している様子がわかる。(拡大画像↗)
植物体の主成分であるセルロース(注2)は、地球上で最も豊富に存在するバイオマスです。セルロースは化学的に極めて安定なので、化学反応でセルロースを分解してその構成糖であるグルコース(ぶどう糖)を得るためには、強い酸やアルカリを高温・高圧条件下で用いなければならないため多くのエネルギーが必要となります。しかし、自然界ではセルロースは様々な微生物が出す「セルラーゼ」という酵素によって常温・常圧で分解され、このような微生物の栄養源として利用されています。つまり、私たちがセルラーゼを使いこなすことができれば、木や草などのセルロース系バイオマスから液体燃料やプラスチックを生産することができるようになるのです。
東京大学大学院農学生命科学研究科の鮫島正浩教授と五十嵐圭日子(きよひこ)准教授のグループは、20年以上にわたってきのこの一種(Phanerochaete chrysosporium)が生産する様々な酵素の研究を行っており、2008年には本菌のゲノム配列から立体反転型の新しいセルラーゼ(注3)を発見し(文献1)、特許を取得しました。このセルラーゼ(PcCel45A)は、糖加水分解酵素(glycoside hydrolase; GH)ファミリー45に属するエンドグルカナーゼの亜種で、カビから取られた本酵素ファミリーの酵素は洗剤に用いられる酵素としてもよく知られています。しかし、この酵素を構成しているアミノ酸の配列を詳細に調べると、セルロースの分解反応を行うために必要と考えられていたアミノ酸の一つが見当たらないことが分かりました。これはPcCel45Aには「活性中心がないのに活性がある」という不思議なことが起こっていることを示しています。
そこで五十嵐准教授らは、本酵素がセルロースを分解する仕組みを明らかにするために、JAXAの保有する高品質タンパク質結晶化技術を活用して本酵素の高品質結晶を作製し、大強度陽子加速器施設(J-PARC)の茨城県生命物質構造解析装置(iBIX)による中性子回折実験を行いました。通常、タンパク質の構造を明らかにするためには「X線」が用いられますが、X線を用いた構造解析では「水素(H)」を見ることが難しく、水(H2O)や水酸基(−OH)、水素結合などの情報を得ることができません。そこで本研究では、X線による構造解析結果と中性子構造解析結果を組み合わせることで、水素の場所を決め、セルラーゼのように「水」を反応に使う酵素の解析に用いることを試みました。しかし、X線と比べて中性子は回折強度が非常に低いので、X線回折実験に使うタンパク質の結晶の1,000倍もの大きさの結晶を準備する必要があり、そのために研究があまり進んでいないというのが現状でした。
東京大学の中村彰彦特別研究員(研究当時、現自然科学研究機構 岡崎統合バイオサイエンスセンター 分子科学研究所 助教)と石田卓也特任助教は、PcCel45Aの超巨大結晶作製に成功し(文献2)、iBIXを用いて本酵素の中性子構造を1.5Åの解像度で明らかにしました。その結果、本酵素では反応を行うと考えられるアミノ酸(92番目のアスパラギン)が、通常の「アミド型」ではなく「イミド酸型」に互変異(注4)を起こしている様子が観察されました。図2に示したように「アミド型」と「イミド酸型」の違いは水素の付き方だけなので、X線による構造解析でこの違いを判別することは非常に難しいですが、中性子構造解析では明らかな違いとして観察できます。しかし「イミド酸」は一般的には不安定な構造であると言われているため、どのようにしてこのような構造が安定化されているのかを調べたところ、105番目のアスパラギンも同じように「イミド酸」になっており、しかも二つのイミド酸に挟まれた部分のペプチド結合(-C(=O)-NH-)(注5)も全てイミド酸型(-C(-OH)=N-)になっていることが明らかとなりました。これまでもタンパク質のペプチド結合は二重結合になり得る(互変異性がある)と言われていましたが、このようにイミド酸型で安定化していることは非常に珍しく、その様な現象が直接的に証明されたのは世界で初めてです。
さらに、この互変異の連鎖を辿っていくと、105番目のアスパラギン以降は通常のアミノ酸側鎖を介した水素結合となり、最終的に水素結合のネットワークは本酵素が反応を行うために必要なもう一つのアミノ酸(114番目のアスパラギン酸)まで繋がっていることが明らかとなりました(図3)。セルラーゼの反応には、これまでに二種類(立体保持型と立体反転型)があることが知られていましたが、立体反転型の酵素がどのように酵素反応を繰り返すのかは不明でした。今回の実験結果から、PcCel45Aは92番目のアスパラギン(イミド酸型)と114番目のアスパラギン酸の間で双方向の水素の玉突きを起こす、つまり「かちかち玉」(英語では「ニュートンのゆりかご(Newton’s cradle)」と呼ばれています)のような反応機構で、反応を繰り返すと考えられました(図4)。
今回の結果は、洗剤にも用いられるようなセルラーゼがどのように反応するのかを詳細に解明することに繋がりました。全てのタンパク質がペプチド結合を持つことを考えると、セルラーゼだけでなく様々なタンパク質でこのような「互変異の連鎖」が起こっている可能性があります。これまでも、タンパク質の構造からコンピュータを用いてタンパク質の機能を改変する研究や医薬品をデザインする研究が盛んに行われてきましたが、その際に「互変異の連鎖」を考慮していることはほとんどありません。今回、中性子構造解析によって初めて明らかにすることが出来た「互変異の連鎖」を考慮することで、これらの研究手法の精度向上につながると考えられます。
本研究により、タンパク質工学研究や創薬研究に大きな影響を及ぼすタンパク質の多彩さ・巧妙さを解明するためにはX線結晶構造解析に加えて水素原子の情報が得られる中性子構造解析が必要であることが明らかになりました。今後、J-PARC/MLF内にある世界最高レベルの測定効率を誇るiBIXによって、タンパク質の多彩さ・巧妙さを次々に解明し、タンパク質化学の発展に寄与することが期待できます。
本研究は、日本学術振興会の科学研究費補助金新学術領域研究「植物細胞壁の情報処理システム」(領域代表:東北大学 西谷和彦 教授)、JAXAオープンラボ公募共同研究(研究代表者:五十嵐圭日子)、JAXA JEM利用高品質タンパク質結晶生成実験(研究代表者:五十嵐圭日子)、文部科学省科学研究費補助金 基盤研究(B)(研究代表者:五十嵐圭日子)、文部科学省地球観測技術等調査研究委託事業「高品質蛋白質結晶化技術の宇宙科学研究拠点形成」(研究代表者:筑波大学 裏出良博 教授)の補助を受けたものです。また,中性子回折実験は,茨城県のiBIXプロジェクト課題を利用して実施したものです。深く感謝いたします。
発表雑誌
- 雑誌名
- 「Science Advances」
- 論文タイトル
- "Newton's cradle" proton relay with amide-imidic acid tautomerization in inverting cellulase visualized by neutron crystallography
- 著者
- Akihiko Nakamura(中村彰彦)、Takuya Ishida(石田卓也)、Katsuhiro Kusaka(日下勝弘)、Taro Yamada(山田太郎)、Shinya Fushinobu,(伏信進矢)、Ichiro Tanaka(田中伊知朗)、Satoshi Kaneko(金子 哲)、Kazunori Ohta(太田和敬), Hiroaki Tanaka(田仲広明)、Koji Inaka(伊中浩治)、Yoshiki Higuchi(樋口芳樹)、Nobuo Niimura(新村信雄)、Masahiro Samejima(鮫島正浩)、Kiyohiko Igarashi*(五十嵐圭日子)
- DOI番号
- 10.1126/sciadv.1500263
- 論文URL
- http://advances.sciencemag.org/content/1/7/e1500263
問い合わせ先
東京大学大学院農学生命科学研究科 生物材料科学専攻 森林化学研究室
准教授 五十嵐 圭日子(いがらし きよひこ)
Tel:03-5841-5258
Fax: 03-5841-5273
E-mail:aquarius@mail.ecc.u-tokyo.ac.jp
用語解説
- 注1 中性子回折法(Neutron diffraction)
- 試料に中性子線を照射し、回折(回り込み)される中性子線のパターンを解析することで試料の原子構造を明らかにする手法。タンパク質の中性子構造解析を行うためには、比較的大型のタンパク質の結晶を作製し、その結晶に中性子線を照射することで原子構造が明らかになります。
- 注2 セルロース(cellulose)
- グルコース(ぶどう糖)が直鎖状につながった多糖で、植物細胞壁の約半分を占める物質です。地球上で、最も豊富に存在する有機物であり、植物によって二酸化炭素と水から光合成によって作り出されるため、再生可能なバイオマスとしての利用が望まれています。
- 注3 立体反転型セルラーゼ(inverting cellulase)
- セルラーゼはセルロースを加水分解する酵素の総称ですが、反応によって生成される糖の構造の違いから、保持型(retaining)と反転型(inverting)に分けられることが知られています。本研究で構造解析が行われたPcCel45Aは、セルロースの分解性から立体反転型であることが知られています。
- 注4 互変異(tautomerization)
- 同じ種類の原子を持っているが構造が異なる二つの物質(異性体)同士が互いに変換する現象。本研究では、アミノ酸の一種であるアスパラギンの側鎖で起こるアミド型(-C(=O)-NH2)とイミド酸型(-C(-OH)=NH)間の互変異と、通常のペプチド結合(-C(=O)-NH-)とそのイミド酸型(-C(-OH)=N-)間の互変異が含まれています。どちらの場合も、水素イオン(プロトン:H+)の移動を伴っていることから「プロトン互変異性」と呼ばれます。
- 注5 ペプチド結合(peptide bond)
- タンパク質は、アミノ酸がいくつもつながってできていますが、その継ぎ目(結合している部分)をペプチド結合と呼びます。これは、アミノ酸が持っているアミノ基(-NH2)と隣のアミノ酸のカルボキシル基(-COOH)が、水を除きながら結合することで-C(=O)-NH-ができます。本研究では、このようにすべてのタンパク質が共通して持つペプチド結合が、周りの環境によってイミド酸型(-C(-OH)=N-)になり得ることを直接示しています。
(文献1)Igarashi, K., Ishida, T., Hori, C., and Samejima, M., Appl. Environ. Microbiol. 74: 5628-5634 (2008)
(文献2)Nakamura, A., Ishida, T., Fushinobu, S., Kusaka, K., Tanaka, I., Inaka, K., Higuchi, Y., Masaki, M., Ohta, K., Kaneko, S., Niimura, N., Igarashi K., and Samejima, M., J. Sync. Rad. 20: 859-863 (2013)