天然由来ヒストン脱アセチル化酵素阻害物質の生合成機構の解明
- 発表者
-
工藤 慧 (東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程3年)
西山 真 (東京大学生物生産工学研究センター 教授)
葛山 智久(東京大学生物生産工学研究センター 准教授)
発表のポイント
◆ヒストン脱アセチル化酵素阻害剤として重要なtrichostatin Aの生合成に関わる全遺伝子を同定しました。
◆trichostatin Aの生物活性の発現に必須な末端ヒドロキサム酸の生合成機構が明らかになりました。
◆ヒドロキサム酸は生物活性に重要な官能基であるため、新たな薬の開発への応用が期待できます。
発表概要
Trichostatin A (TSA)は放線菌の生産する二次代謝産物(注1)の一つで、ヒストン脱アセチル化酵素 (HDAC)の阻害剤として生化学の分野で広く利用されています。TSAのHDAC阻害活性には、ヒドロキサム酸基(注2)が重要な役割を果たすことが既に知られていますが、これまでヒドロキサム酸基がどのように作られるかは不明のままでした。
今回の研究で、東京大学生物生産工学研究センターと産業技術総合研究所の共同研究グループはTSAを作るために必要な全ての遺伝子を同定し、それらの働きを解明しました。さらに、同グループは遺伝子工学の手法を用いてTSAの高生産株を作製するとともに、組換えタンパク質を用いた試験管内反応によりTSAのヒドロキサム酸基を作るための新しい機構を提唱しました。
この結果により、ゲノムマイニング(注3)に基づく新規ヒドロキサム酸含有化合物の探索が可能になるほか、新たな薬の候補化合物の創出につながると期待されます。
発表内容
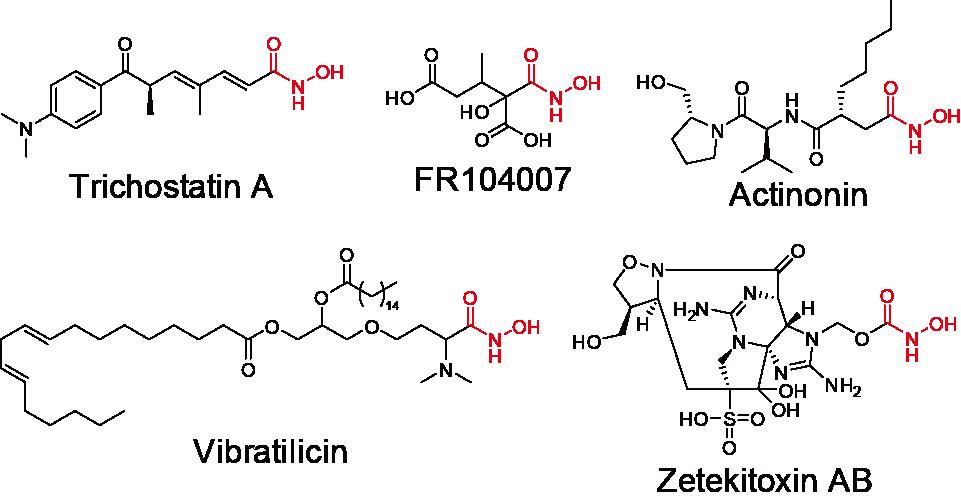
図1 ヒドロキサム酸含有天然化合物の例。赤色の部分がヒドロキサム酸基。
(拡大画像↗)
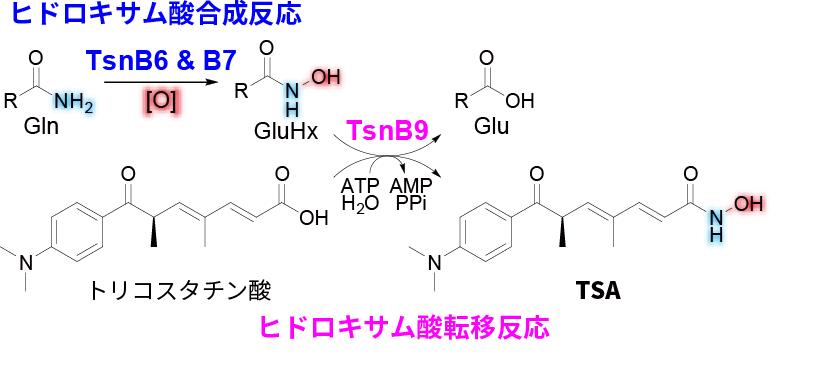
図2 TSAの末端ヒドロキサム酸基形成機構。青色で示したTsnB6とTsnB7が協働して、グルタミン (Gln) からグルタミン酸γモノヒドロキサム酸 (GluHx) を生成する。マゼンタで示したTsnB9はGluHxからトリコスタチン酸へのヒドロキサム酸基の転移反応を触媒し、最終産物のTSAを生合成する。
(拡大画像↗)
放線菌は多種多様な生物活性を示す二次代謝産物を生産する微生物として知られています。二次代謝産物の一つ、trichostatin A (TSA) (図1)は、1976年に塩野義製薬の研究グループによって発見された化合物です(文献1)。当初は抗真菌活性物質として発見されたTSAですが、1990年に本研究科の吉田稔博士の研究グループがヒストン脱アセチル化酵素 (HDAC) の強力な阻害剤であることを解明しました(文献2)。それ以降、HDACを中心としたエピジェネティクス分野(注4)の発展において、TSAは大きな役割を果たしています。また近年、TSAと類似した構造のボリノスタットが医薬品として承認され、抗がん剤として臨床利用されています。このように幅広く利用されてきたTSAですが、放線菌がどのようにして生合成するのかは明らかにされていませんでした。生合成経路の解明は、人為的な経路改変によって非天然型の生物活性物質を設計する上で非常に重要な知見を与えます。そこで東京大学生物生産工学研究センターと産業総合技術研究所の共同研究グループは、TSA生産菌Streptomyces sp. RM72株を用いて研究を行いました。
まず、TSAの生合成に関与する遺伝子を特定するため、RM72株のゲノムシーケンスを行い、ゲノムマイニングによって約27 kbのTSA生合成遺伝子群を同定しました。次にこの領域をコスミドベクターにクローニングし、TSAを生産しない異種放線菌Streptomyces albusに導入することで、TSAの異種生産に成功しました。この異種生産株はRM72株の約17倍のTSA生産能を示したことから、遺伝子組換え技術によってTSAの高生産株を作出することができました。
次に、TSAのHDAC阻害活性に重要なヒドロキサム酸基の生合成遺伝子を探索しました。微生物変換実験によって、TsnB6、TsnB7、TsnB9の3つのタンパク質が、TSA前駆体であるトリコスタチン酸からTSAへの変換を担うことが分かりました。さらに、精製したタンパク質と基質を試験管内で混合することで、TsnB9がタンパク質を構成しないアミノ酸であるグルタミン酸γモノヒドロキサム酸 (GluHx) からトリコスタチン酸へのヒドロキサム酸の転移反応を触媒すること、TsnB6とTsnB7が協働してグルタミンを酸化してGluHxを合成することを証明しました(図2)。GluHxが生体物質として機能することを示したのはこれが初めての例です。今回明らかにしたヒドロキサム酸基の形成機構は、これまで知られていたペプチド結合中のヒドロキサム酸の形成機構とは全く異なり、TSAのような末端ヒドロキサム酸の生合成に特徴的な機構であることが分かりました。
末端にヒドロキサム酸基を有する天然化合物はTSAの他にも数種類が知られており(図1)、様々な酵素の阻害剤として機能することが知られています。このことから、ヒドロキサム酸含有天然化合物は、ケミカルバイオロジー(注5)の重要な道具であると言えます。本研究で明らかになった生合成機構を指標にゲノムマイニングを行うことで、これまで見逃されていた新たなヒドロキサム酸基含有天然化合物を発見できると考えられます。さらに今後は、TsnB9の立体構造解析を行うことでヒドロキサム酸転移反応の詳細な触媒機構を明らかにできれば、TsnB9の機能改変によって、既存の化合物への人為的な末端ヒドロキサム酸基の導入が可能になると期待できます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業」と文部科学省科学研究費補助金新学術領域研究(研究領域提案型)「生合成リデザイン」の支援を受けて行われました。
参考文献
1. Tsuji N. Kobayashi M. Nagashima K. Wakisaka Y. Koizumi K. J. Antibiot. 29: 1–6 (1976).
2. Yoshida M. Kijima M. Akita M. Beppu T. J. Biol. Chem. 265: 17174–17179 (1990).
発表雑誌
- 雑誌名
- :Journal of the American Chemical Society 139: 6799–6802 (2017).
- 論文タイトル
- :Biosynthetic Origin of the Hydroxamic Acid Moiety of Trichostatin A: Identification of Unprecedented Enzymatic Machinery Involved in Hydroxylamine Transfer
- 著者
- :Kei Kudo (工藤 慧)1、Taro Ozaki (尾崎 太郎)1、Kazuo Shin-ya (新家 一男)2、Makoto Nishiyama (西山 真)1、Tomohisa Kuzuyama (葛山 智久)1*
1Biotechnology Research Center, The University of Tokyo
2National Institute of Advanced Industrial Science and Technology
- DOI番号
- :10.1021/jacs.7b02071
- 論文URL
- :http://pubs.acs.org/doi/abs/10.1021/jacs.7b02071
問い合わせ先
- 東京大学生物生産工学研究センター 細胞機能工学研究部門
准教授 葛山 智久(くずやま ともひさ)
Tel:03-5841-3073
Fax:03-5841-8030
研究室URL:http://park.itc.u-tokyo.ac.jp/biotec-res-ctr/saiboukinou/
用語解説
- 注1 二次代謝産物
- 生命にとって必要不可欠な代謝物を一次代謝産物と呼び、それ以外の代謝物を二次代謝産物と呼ぶ。二次代謝産物は標的や作用が多様な生物活性を示すことが多く、人間はこれを医薬品などに利用しているが、二次代謝産物の生産者自身にとっての役割はほとんど分かっていない。
- 注2 ヒドロキサム酸基
- 図1に赤色で示した、アミド結合中の窒素原子が水酸化された官能基。様々な二価金属イオンのキレート剤として働くことが知られている。
- 注3 ゲノムマイニング
- 遺伝子の情報を手掛かりに、生物のゲノム配列から特定の機能を持つ遺伝子(群)を探し出すこと。
- 注4 エピジェネティクス分野
- DNA配列の変化を伴わない細胞分裂後も継承される遺伝子発現あるいは細胞表現型の変化を研究する学問分野
- 注5 ケミカルバイオロジー
- 化合物を基礎として生命現象を扱う学問領域。ある生体分子(タンパク質、核酸など)の機能に影響を与える化合物があれば、その生体分子の生命システムにおける機能を調べることができる。TSAのHDAC阻害活性の発見からHDAC研究が勃興したのは、その代表例の一つである。