脱窒菌が毒性の中間体である一酸化窒素により細胞損傷を受けない原因を解明
- 発表者
-
寺坂 瑛里奈(理化学研究所 放射光科学総合研究センター 研修生;当時)
山田 健太(理化学研究所 杉田理論分子科学研究室 特別研究員)
新井 博之(東京大学大学院農学生命科学研究科 応用生命工学専攻 准教授)
杉田 有治(理化学研究所 杉田理論分子科学研究室 主任研究員)
城 宜嗣 (兵庫県立大学大学院生命理学研究科 教授/理化学研究所 放射光科学総合研究センター 主任研究員;当時)
當舎 武彦(理化学研究所放射光科学総合研究センター 専任研究員)
発表のポイント
◆微生物による脱窒反応において、一酸化窒素(NO)を合成する酵素と分解する酵素が複合体を形成することで、速やかにNOを分解していることを発見しました。
◆この仕組みにより脱窒菌は細胞毒であるNOにより細胞損傷を受けないことが分かりました。
◆本成果は生体内におけるNOシグナル伝達の理解に留まらず、様々な生理反応のメカニズムの理解につながると期待できます。
発表概要
一酸化窒素(NO)(注1)は生体内において、シグナル伝達物質として種々の生理反応に関与するという「正」の側面を持つ一方、細胞損傷を引き起すという「負」の側面を持ちます。そのため、生体内にはNOの「負」の側面を抑制し、「正」の側面を利用する巧妙なシステムが存在すると考えられます。しかし、その詳細は明らかになっていませんでした。
今回、理化学研究所(理研)放射光科学総合研究センターの當舎武彦専任研究員、城宜嗣主任研究員、理研杉田理論分子科学研究室の杉田有治主任研究員、東京大学大学院農学生命科学研究科の新井博之准教授らの共同研究チームはこのシステムを理解するために、細菌が行う脱窒(注2)という生理反応に注目しました。脱窒では、中間生成物としてNOが生成されるものの、脱窒を行う細菌は、自身が合成するNOによって細胞損傷を受けることがありません。そこで、共同研究チームは、脱窒においてNOを合成する亜硝酸還元酵素(NiR)(注3)とNOを分解する一酸化窒素還元酵素(NOR)(注4)が連携して機能することで、効率よくNOを分解していると考えました。実際に大型放射光施設「SPring-8」(注5)を利用したX線結晶構造解析を行ったところ、“NOを合成するNiR”と“NOを分解するNOR”が複合体を形成することを発見しました。そして、この酵素タンパク質複合体形成のおかげで、細菌は、細胞毒であるNOを細胞環境に拡散させずに、効率的に分解していることを明らかにしました。
本成果は、脱窒における効率的なNO分解の仕組みの理解のみならず、生体内におけるNOシグナル伝達の理解にもつながるものといえます。また、今回解明した脱窒をモデルとした反応系は、NO動態制御以外の他の生理反応にも適用できる普遍性のある概念であることから、さまざまな生理反応のメカニズムの理解につながると期待できます。
発表内容
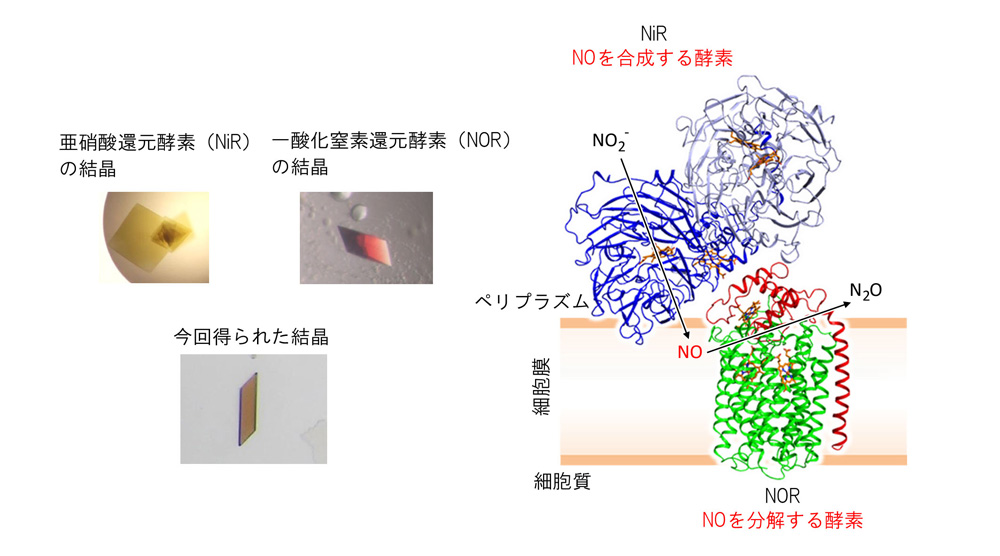
図1 亜硝酸還元酵素:一酸化窒素還元酵素(NiR:NOR)複合体の結晶と立体構造
左は、今回得られた結晶の写真とNiR およびNOR の結晶の写真を示している。NiR の緑色とNOR の赤色を含んだ茶色の結晶が得られた。右は、NiR:NOR 複合体の全体構造を示している。ペリプラズムに存在する青で示したNiR と、細胞膜上にある赤と緑で示したNOR が複合体を形成していることが分かる。 (拡大画像↗)
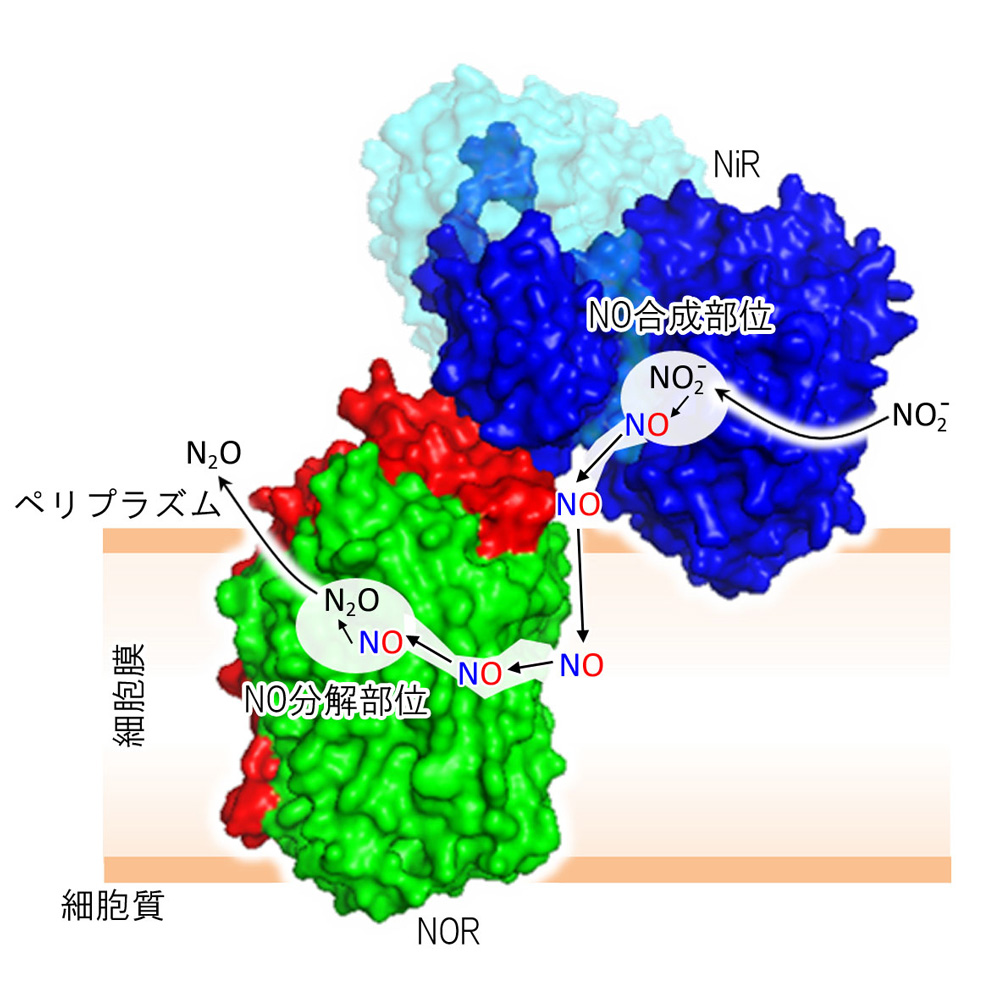
図2 推定されるNO 伝達経路
NiR:NOR 複合体の結晶構造をもとに分子動力学計算を行い、NiR により合成されたNO がNOR に受け渡される経路を検討した。NiR の合成部位で生成したNO は、NiR に存在するチャネルを通って放出され、速やかに細胞膜内に入る。その後、細胞膜中に存在するNOR のNO 結合チャネルを通って、NOR のNO 分解部位へと伝達される。(拡大画像↗)
一酸化窒素(NO)は、ガス状の分子であり、生体内においてシグナル分子として機能し、血管の拡張や記憶の形成など種々の生理反応に関与するという「正」の側面を持ちます。一方でNOは、反応性が高く種々の生体分子との反応を通じて強い細胞毒性を示すという「負」の側面も持ちます。そのため、生体内にはNOの「負」の側面を抑えつつ、利用するためのシステムが存在すると考えられます。しかし、その詳細は明らかになっていません。
この生体が持つシステムに関する理解を深めるために、共同研究チームは、細菌が酸素のない環境で生きるために行う脱窒(嫌気呼吸の一種)に着目しました。脱窒は、窒素酸化物を窒素分子にまで段階的に還元する反応ですが、NOが中間生成物として合成されます。しかし、このような細菌は、自身が合成したNOによって損傷を受けることなく生育できます。これは、脱窒には、NOを細胞環境に拡散させずに効率的に分解する仕組みが存在することを意味しています。しかし、脱窒では、どのようにして細胞毒性の高いNOが分解されているのかは明らかになっていませんでした。
脱窒において、NOを合成するのは、ペリプラズム(注6)に存在する亜硝酸還元酵素(NiR)で、NOを分解するのは細胞膜上に存在する一酸化窒素還元酵素(NOR)です。そこで共同研究チームは、NiRが合成したNOを細胞環境に拡散させずにNORが分解するために、これらの酵素が協力して機能していると考えました。
【研究手法と成果】
共同研究チームは、これまでに研究を行ってきた緑膿菌(注7)由来のNiRとNORに注目して研究を行いました。緑膿菌からNORを精製し、NORと相互作用するタンパク質を探したところ、NiRがNORと相互作用することを発見しました。そこで、緑色のNiRと赤色のNORを混合し、結晶化させたところ、NiR:NOR複合体が生成されていることを示す茶色の結晶を得ることに成功しました(図1)。大型放射光施設「SPring-8」のBL41XU(構造生物学ビームライン)を用いて、得られた結晶に高輝度X線を照射し測定したデータを解析することで、NiR:NOR複合体の構造を3.2オングストローム(1Åは100億分の1メートル)の分解能で決定しました(図1)。 得られた構造および、その構造を用いた分子動力学計算(注8)から、NiRとNORの複合体形成に寄与するアミノ酸残基を割り出しました。この結果に基づいて、NiRとの複合体形成ができなくなるように緑膿菌内のNORに変異を加えたところ、このようなNOR変異体を持つ緑膿菌では、菌体内にNOが蓄積し生育速度が大きく低下することが分かりました。この結果は、NiR:NOR複合体形成がNOの迅速な分解に関わっていることを示しています。
また、構造に基づいた分子動力学計算から、NiRが合成したNOがどのようにしてNORの活性部位に輸送されるのかが推定できました(図2)。NiRはNORと複合体を形成することによって、NORの近くでNOを合成することになります。いったん生成したNOは、速やかにNORの活性部位へと輸送されるため、NOは細胞環境に漏れ出すことなくNORによって分解されると考えられます。
NORが発見される以前には、脱窒ではNOの生成を経由しないと考えられていました。それほど、NOの分解は速やかに行われることが知られています。これまで、どのようにしてNOの分解が迅速に行われるのか分かっていませんでしたが、今回の研究から、NOの合成酵素(NiR)と分解酵素(NOR)が連携することでNiRが合成したNOをNORが直ちに分解する仕組みを解明できました。
【今後の期待】
本研究では、細胞内におけるNO動態の制御の一例として、NOの合成および分解に関わる酵素が複合体を形成することで、細胞毒NOが細胞環境に漏れ出すのを抑制する仕組みを示すことができました。脱窒の過程で生じる亜硝酸イオン(NO2-)もNOと同様に高い細胞毒性を示すことから、亜硝酸イオンの合成・分解に関与するタンパク質もNiRとNOR同様に複合体を形成することが予想されます。このような一連の生理反応において、その反応に関与するタンパク質が複合体を形成することで効率的に反応を行っているという考え方は、他の生理反応にも適用できる普遍性のある概念です。脱窒をモデル反応系とした研究が進むことで、効率的な生理反応のメカニズムを理解することにつながります。
また、本研究成果は、生体内でのNOシグナル伝達において、どのようにして生体分子がNOの細胞毒性を抑えつつNOを利用しているのかを理解する手掛かりになると期待できます。
発表雑誌
- 雑誌名
- :「Proceedings of the National Academy of Sciences in USA」オンライン版8月28日
- 論文タイトル
- :Dynamics of Nitric Oxide Controlled by Protein Complex in Bacterial Systeme
- 著者
- :Terasaka Erina, Kenta Yamada, Po-Hung Wang, Kanata Hosokawa, Raika Yamagiwa, Kimi Matsumoto, Shoko Ishii, Takaharu Mori, Kiyoshi Yagi, Hitomi Sawai, Hiroyuki Arai, Hiroshi Sugimoto, Yuji Sugita, Yoshitsugu Shiro, Takehiko Tosha
- DOI番号
- :10.1073/pnas.1621301114
- 論文URL
- :http://www.pnas.org/content/early/2017/08/22/1621301114.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 応用微生物学研究室
准教授 新井 博之
Tel:03-5841-1741
E-mail:aharai<at>mail.ecc.u-tokyo.ac.jp<at>を@に変えてください。
理化学研究所 放射光科学総合研究センター ビームライン基盤研究部
専任研究員 當舎 武彦
Tel:0791-58-2817
E-mail:ttosha<at>spring8.or.jp<at>を@に変えてください。
用語解説
- 注1 一酸化窒素(NO)
- 1個の不対電子を持つラジカルで、ガス状の二原子分子。反応性が高いため、生体内ではシグナル伝達物質として利用されている。一方で、タンパク質、核酸や脂質と反応することで細胞損傷を引き起こす。
- 注2 脱窒
- 可溶性の窒素酸化物を窒素分子にまで段階的に還元し、大気に再び放出する過程を脱窒と呼ぶ。主に土壌細菌などによって行われ、地球上の窒素循環において重要な役割を担っている。別名、硝酸塩呼吸と呼ばれる嫌気呼吸(酸素分子以外を電子受容体とする呼吸)の一種。
- 注3 亜硝酸還元酵素(NiR)
- ペリプラズム(注6参照)に存在し、亜硝酸イオン(NO2-)を還元し、一酸化窒素(NO)を合成する酵素。
- 注4 一酸化窒素還元酵素(NOR)
- 細胞膜に存在し、一酸化窒素(NO)を還元し、亜酸化窒素(N2O)へと無毒化する酵素。脱窒を行う細菌のほか、いくつかの病原菌にもみられる。
- 注5 大型放射光施設「SPring-8」
- 理研が所有する、兵庫県の播磨科学公園都市にある第三世代放射光施設。SPring-8の名前はSuper Photon ring-8GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細くて強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。今回、X線回折実験に利用したBL41XUでは、実験室レベルでのX線発生装置では構造解析が不可能な微小結晶であっても、高分解能でのデータ取得が可能。
- 注6 ペリプラズム
- 細菌において細胞膜と細胞外膜の二つの生体膜によって挟まれた領域。
- 注7 緑膿菌(Pseudomonas aeruginosa)
- 環境中に広く分布する常在菌の一種で、代表的な日和見感染菌。酸素分子のない嫌気下では、脱窒により生きるためのエネルギーを得ている。
- 注8 分子動力学計算
- 原子間に働く力を計算し、運動方程式を繰り返し解くことで、分子や原子の動きを追跡する計算科学の手法。