癌血管の悪性化を止める酵素の発見
- 発表者
-
大森 啓介(東京大学大学院農学生命科学研究科 応用動物科学専攻 博士課程4年)
中村 達朗(東京大学大学院農学生命科学研究科 応用動物科学専攻 特任助教)
村田 幸久(東京大学大学院農学生命科学研究科 応用動物科学専攻 准教授)
発表のポイント
◆マウスの皮膚癌や肺癌、乳癌の血管内皮細胞において、他組織の血管内皮細胞では見られないリポカリン型プロスタグランジンD合成酵素(L-PGDS)が、強く発現しており、この酵素から産生されるプロスタグランジンD2(PGD2)が、血管の透過性や新生を抑制し、癌への栄養や酸素の供給を制限する分子であることを発見した。また薬を用いてPGD2の受容体を刺激することで、血管の透過性や新生を抑え、癌の増殖を抑えることに成功した。
◆癌の中の血管は正常組織の血管と違った形態や性状を持つと考えられてきたが、詳細は分かっていなかった。本発見は、癌血管のみに起こる分子発現や機能の変化を初めて明らかにしたものである。
◆増殖する癌に栄養や酸素を補給する血管は、新しい抗癌剤の標的として注目されている。本研究で見出した癌血管の機能変化やそれを止める分子の発見は、新しい癌治療法の開発につながることが期待される。
発表概要
急速に増殖する癌は、周囲の組織から血管を引き寄せ、増殖に必要な酸素や栄養を獲得する。この癌の中に伸びてきた血管は、その多くが血管内皮細胞で構成され、漏れやすく、新生しやすい(伸びやすい)など、他の正常組織の血管とは違った性質をもっている。この癌血管と正常血管の違いを見つけ、正すことができれば、癌への酸素・栄養補給を断つことができる新しい抗癌治療法の開発につながるため、現在研究が進んでいる。
東京大学大学院農学生命科学研究科の村田幸久准教授と大森啓介大学院生らの研究グループは、マウスに移植した肺癌や皮膚癌の血管内皮細胞にプロスタグランジン(注1)合成酵素の一種であるL-PGDSが強く発現していることを発見した。このL-PGDSは正常な皮膚の血管にはほとんど発現していなかった。詳細な解析の結果、癌が産生する炎症性物質によってこの酵素は血管内皮に誘導され、そこから産生されるPGD2は血管の透過性(注2)や新生(注3)を抑制して、癌組織への栄養や酸素の供給を制限するブレーキとしての働きをもつことが分かった。この発見は、癌の血管のみを標的とした、副作用の少ない新たな治療法の開発につながる可能性がある。
発表内容
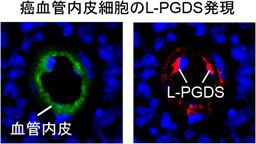
図1 癌組織におけるL-PGDSの免疫蛍光染色の典型写真。L-PGDSは癌の血管内皮細胞に特異的に発現していた。
(拡大画像↗)
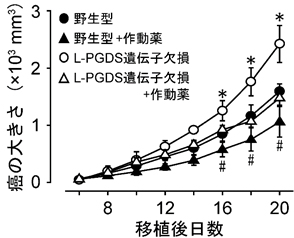
図2 癌増殖のグラフ。L-PGDS遺伝子欠損マウスでは癌の増殖が野生型マウスと比較して速く、PGD2のシグナルを強める受容体作動薬は癌の増殖を抑えた。
(拡大画像↗)
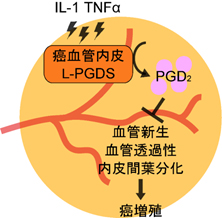
図3 癌血管内皮で発現上昇したL-PGDSはPGD2を産生し、血管新生や血管透過性、血管内皮間葉分化転換を抑えることで、無秩序に増殖する癌のブレーキとして作用していることが分かった。
(拡大画像↗)
癌(悪性新生物)は我が国の死亡原因の第一位であり、来る高齢化社会に向けて副作用のより少ない新たな治療薬の開発が求められている。固形癌は、正常組織の血管に働きかけて、漏れやすい新しい血管を作らせて引き寄せ(血管新生させ)、この血管を通じて栄養や酸素を補給することで増殖し続ける。このため、癌血管の漏れや新生が起こる原因を明らかにし、抑える機構を見つけることができれば、新しい抗癌剤の標的になると期待されている。これまで、癌に伸びた血管は正常組織の血管と比べて、拡張・蛇行しているなど、その形態的な特徴が大きく異なることが報告されてきた。しかし、分子レベルにおけるその特徴を明らかにした報告は少ない。
【研究内容】
①癌の血管内皮においてL-PGDSの発現量が顕著に増加した。
マウスに皮膚癌や肺癌、乳癌をそれぞれ移植し、癌血管内皮を単離して、その遺伝子発現量を網羅的に解析した。その結果、L-PGDSの発現量が正常皮膚血管内皮と比較して約10倍も増加していることが分かった(図1)。免疫染色を行ったところ、癌組織においてL-PGDSは血管内皮のみに発現しており、その発現はマウスへの移植癌のみならず、ヒトの悪性黒色腫や口腔扁平上皮癌においても確認された。ヒト内皮細胞を用いた検討の結果、L-PGDSは癌細胞由来の炎症性サイトカインであるインターロイキン-1(IL-1)や腫瘍壊死因子-α(TNFα)によって発現が促されることが分かった。
②L-PGDSはPGD2を産生し、癌の増殖を抑制した。
L-PGDSの機能を調べる目的で、遺伝子欠損マウスを作製し、皮膚癌を移植したところ、癌は野生型のマウスよりも約2倍速く増殖した(図2)。この時L-PGDSの生成物であるPGD2は、L-PGDS欠損マウスの癌組織において減少していた。またPGD2のシグナルを強める受容体作動薬をマウスに処置すると、癌の増殖が抑えられることが分かった(図2)。
③L-PGDSは血管透過性や血管新生、血管内皮間葉分化転換を抑制し、癌への栄養や酸素の供給を阻害した。
癌血管の機能や構造をより詳細に検討した。その結果、L-PGDSの欠損は移植癌において、癌血管の数を増やし、その透過性を亢進させ、癌細胞へ栄養や酸素供給を増やすことがわかった。
【考察・社会的意義】
癌細胞からの炎症刺激により、血管内皮ではL-PGDSの発現が上昇し、そこから産生されるPGD2は、血管の透過性や新生を抑制することで、無秩序に増殖する癌のブレーキとして作用することが明らかとなった(図3)。また、そのシグナルの増強により、異常な癌血管の性状を正し、癌の増殖を抑えることが出きることを発見した。本研究成果は癌に対する新たな治療標的を提案するものである。
発表雑誌
- 雑誌名
- :The Journal of Pathology
- 論文タイトル
- :Lipocalin-type prostaglandin D synthase-derived PGD2 attenuates malignant properties of
endothelial cells in tumor - 著者
- :Keisuke Omori, Teppei Morikawa, Akiko Kunita, Tatsuro Nakamura, Kosuke Aritake, Yoshihiro Urade, Masashi Fukayama, Takahisa Murata
- DOI番号
- :10.1002/path.4993
- 論文URL
- :http://onlinelibrary.wiley.com/doi/10.1002/path.4993/full
問い合わせ先
東京大学大学院農学生命科学研究科 応用動物科学専攻 放射線動物科学教室
准教授 村田 幸久(むらた たかひさ)
Tel: 03-5841-7247
Fax: 03-5841-8183
研究室URL:http://www.vm.a.u-tokyo.ac.jp/houshasen/index.html
用語解説
- 注1 プロスタグランジン(PG)
- 細胞膜脂質から産生される生理活性物質。炎症反応の主体をなす。主なものとしてPGE2、PGI2、PGF2、PGD2、TXA2などがある。
- 注2 血管透過性
- タンパク質や血球のような比較的大きな物質や細胞が、血管の中から外へ出るときの出 やすさ。炎症時には、傷害をうけた組織で血管透過性が上昇する
- 注3 血管新生
- 既存の血管から新たな血管が作られること。炎症時には傷害を受けた組織で血管新生が亢進する。