植物ホルモンのマスター転写因子BIL1/BZR1の特異的な立体構造を解明
- 発表者
-
野﨑 翔平(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士課程3年生)
宮川 拓也(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任准教授)
徐 玉群(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任助教)
中村 顕(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任助教:研究当時)
平林 佳(東京大学大学院農学生命科学研究科 応用生命化学専攻 特別研究員)
浅見 忠男(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
中野 雄司(理化学研究所 環境資源科学研究センター 機能開発研究グループ 専任研究員)
田之倉 優(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任教授)
発表のポイント
◆真核生物で広く保存されているbHLHファミリー転写因子との詳細な比較解析により、 BIL1/BZR1に特異的な塩基配列認識を可能にする構造基盤を明らかにしました。
◆本研究で見出された構造基盤は、ブラシノステロイドをもつ高等植物において高度に保存さ れており、植物がブラシノステロイド特異的かつ多様な遺伝子応答を引き起こすための仕組みの一つであると考えられます。
発表概要
東京大学大学院農学生命科学研究科の宮川拓也特任准教授と田之倉優特任教授、理化学研究所環境資源科学研究センターの中野雄司専任研究員を中心とした研究グループは、ブラシノステロイドのマスター転写因子BIL1/BZR1とその標的DNAの複合体構造をX線結晶構造解析法により決定しました。これは、高等植物で高度に保存されているBZRファミリー転写因子において初めて解明された三次元構造です。BIL1/BZR1及びアミノ酸配列の類似性をもつbHLHファミリー転写因子の立体構造とDNA結合特性を詳細に比較することにより、BIL1/BZR1に特有の塩基配列認識のメカニズムを分子レベルで説明しました。本研究で明らかにしたBIL1/BZR1の構造基盤は、非常に多くの高等植物において進化的に保存されており、植物におけるブラシノステロイド応答遺伝子の多様性を生み出す仕組みの一つであると推測されます。
発表内容
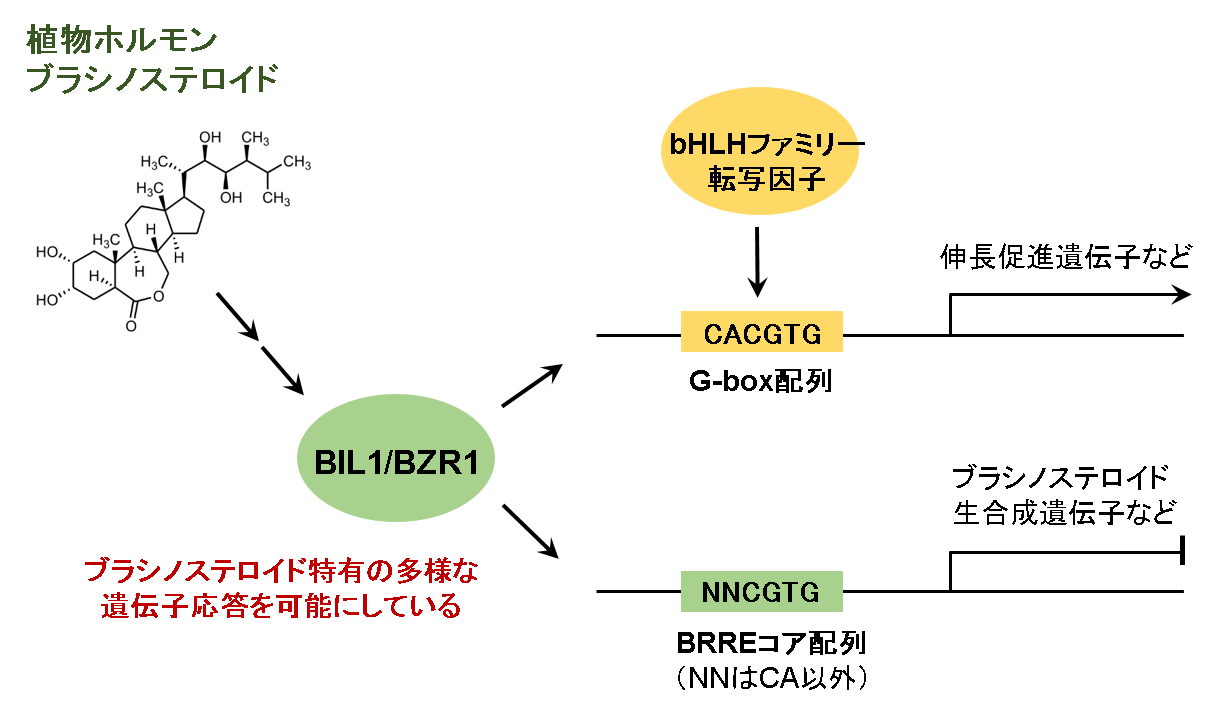
図1 転写因子BIL1/BZR1を介したブラシノステロイド特有の遺伝子応答
植物ホルモンのブラシノステロイドの情報はBZRファミリー転写因子BIL1/BZR1を刺激します。活性化されたBIL1/BZR1は標的遺伝子のプロモーター領域上の標的配列を認識し、ブラシノステロイド応答性遺伝子を制御します。BIL1/BZR1の塩基配列認識の特異性は、G-box配列認識によって引き起こされる他の植物ホルモンや環境シグナルと協調的なブラシノステロイドの生理作用に加え、G-box配列を厳密に認識するbHLHファミリー転写因子等と競合しない他の遺伝子応答を制御することに適しています。(拡大画像↗)
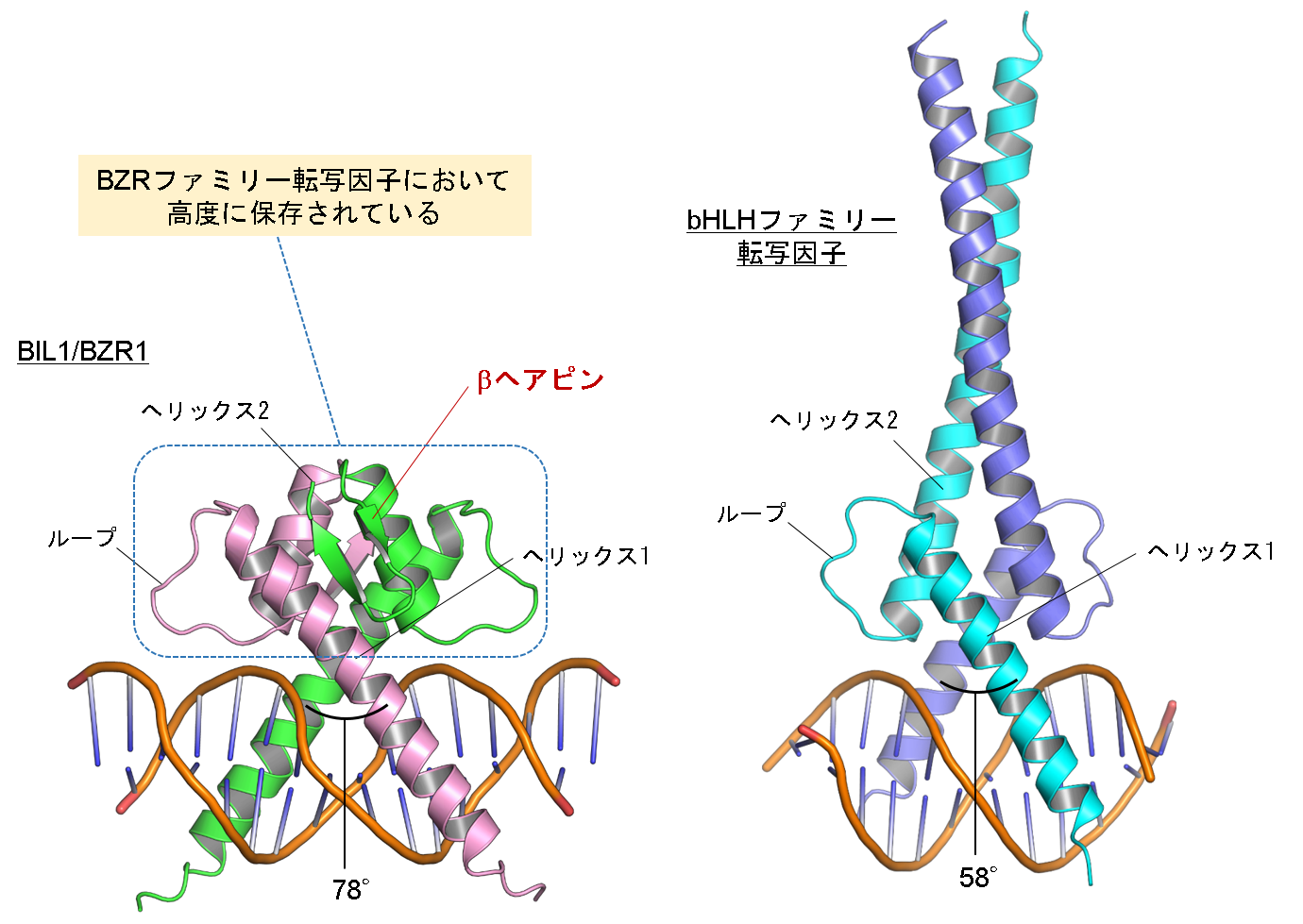
図2 BIL1/BZR1とbHLHファミリー転写因子の全体構造比較
シロイヌナズナ由来BIL1/BZR1はbHLHファミリー転写因子(図では例としてシロイヌナズナ由来MYC2の構造を表示)と同様にヘリックス1 / ループ / ヘリックス2から構成されたホモ二量体構造を形成しており、ニ本のヘリックスを用いてDNAを挟み込んでいました。しかしながらBIL1/BZR1においては、短いヘリックス2のC末端側にβヘアピン構造が形成されていました。このBIL1/BZR1特異的な二量体形成に係わる残基はBZRファミリー転写因子において高度に保存されていました。また二量体構造の違いに伴い、BIL1/BZR1におけるDNA認識ヘリックス間の角度がbHLHファミリー転写因子に比べて約20°も大きくなっていました。 (拡大画像↗)

図3 BIL1/BZR1とbHLHファミリー転写因子のDNA結合様式の比較
BIL1/BZR1及びbHLHファミリー転写因子(図では例としてシロイヌナズナ由来MYC2の構造を表示)のGlu(i)による塩基C1A2の認識様式が上図に示されています。これらの塩基認識様式には「Glu(i)の配向及びGlu(i)とC1A2間の水素結合の距離・角度・水分子の仲介の有無」という点で違いが見られました。下図にはGlu(i)、Arg(i+3)、DNAが係る相互作用ネットワークが示されています。Glu(i)を塩橋で固定するArg(i+3)はDNAのリン酸基との相対位置の違い等により異なる配向・相互作用様式をとっていました(小球(w)は水分子を、大球(P‒1, P0, P1)はDNA主鎖のリン酸基を表しています)。また、Arg(i+3)はループ上のグルタミン酸残基Asp64とも塩橋を形成していました。(拡大画像↗)
本研究ではまずBIL1/BZR1のDNA結合ドメインが、真核生物に広く保存されているbHLHファミリー転写因子(注2)に類似したアミノ酸配列モチーフをもつことに着目しました。典型的なbHLHファミリー転写因子は、DNA認識ヘリックス上のi番目のグルタミン酸残基Glu(i)、i+3番目のアルギニン残基Arg(i+3)、i+4番目のアルギニン残基Arg(i+4)を用いてG-box配列(5’-CACGTG-3’)と呼ばれる回文構造の塩基配列を選択的に認識します。BIL1/BZR1においてもDNA認識ヘリックスと予想される領域にこれら3つの残基が存在しますが、BIL1/BZR1はG-box配列の中のC1A2(またはT5G6)に対する認識が緩いという違いが見られました。
次に、BIL1/BZR1の塩基配列認識のメカニズムを理解するため、実験植物シロイヌナズナ由来のBIL1/BZR1とG-box配列を含むDNAとの複合体の立体構造をX線結晶構造解析法(注3)により決定しました。BIL1/BZR1 の構造はbHLHファミリー転写因子と同様にヘリックス1 / ループ / ヘリックス2からなり、ホモ二量体の形成によりへリックス1がDNAの主溝にはまり込む形でDNAに結合していました(図2)。一方、BIL1/BZR1においては、bHLHファミリー転写因子とは異なり短いヘリックス2のC末端側にβヘアピン構造が形成されていました。この構造はBIL1/BZR1の二量体界面に位置することで、ヘリックス1間の角度をbHLHファミリー転写因子よりも約20°も広げていることがわかりました。
BIL1/BZR1の塩基認識について複合体構造を調べたところ、塩基認識に係わる残基はbHLHファミリー転写因子と同様にDNA認識ヘリックス上のGlu(i)、Arg(i+3)、Arg(i+4)であることがわかりました。一方、BIL1/BZR1とbHLHファミリー転写因子の構造比較では、Arg(i+4)によるG4(C3の相補塩基)の認識様式は両者で共通であるのに対し、Glu(i)によるC1A2(T5G6の相補塩基)の認識様式はGlu(i)の配向の変化により異なっていました(図2)。さらに詳細な解析の結果、BIL1/BZR1のGlu(i)はbHLHファミリー転写因子と同様にArg(i+3)及びDNAを交えた相互作用ネットワークにより固定されていましたが、ネットワーク形成様式やArg(i+3)が相互作用するDNAのリン酸基が異なっていることがわかりました(図3)。興味深いことに、DNAのリン酸基の位置はBIL1/BZR1の大きく傾いたヘリックス1とそれに伴うループの特徴的な配置によって空間的に制限されていました。以上の構造的知見は、BIL1/BZR1の二量体形成領域におけるβヘアピン構造が、大きく傾いたヘリックス1を通じてDNAの形状に制約を与え、DNAとの相互作用ネットワークの形成様式を変化させることにより、Glu(i)のC1A2に対する認識(水素結合形成)を緩めていることを強く示唆しています。また、BIL1/BZR1の二量体形成やDNAとの相互作用に係わる残基はいずれも、高等植物のみならずコケやシダを含む陸上植物のBZRファミリー転写因子においても高度に保存されており、BZRファミリー転写因子の最も重要な特徴であると考えられます。
生体内では同じ塩基配列モチーフが数多くの転写因子によって認識されており、これが生命現象の複雑さを生み出す一因になっています。G-box配列はこのような塩基配列の一つであり、植物のゲノム上に多数点在しbHLHファミリー転写因子を含むさまざまな転写因子に認識されています。本研究における解析により、BIL1/BZR1はbHLHファミリー転写因子と同様にG-box配列結合型の転写因子であり、bHLHファミリー転写因子とは競合しうる関係にあることを明らかにしました。さらに本研究は、同じG-box配列結合型の転写因子にもかかわらず、BIL1/BZR1とbHLHファミリー転写因子間ではC1A2に対応する塩基認識の厳密さが異なること、またその違いを生み出すための構造基盤を明らかにすることができました。BIL1/BZR1のDNA認識の特異性は、G-box配列認識によって他の植物ホルモンや環境シグナル(光や温度等)と協調的に働くブラシノステロイドの生理作用に加え、G-box配列を厳密に認識するbHLHファミリー転写因子等と競合しない他の遺伝子応答を制御することができるといった生理学的意義があると考えられます。実際に、ブラシノステロイド特異的に制御を受ける(他の情報伝達には制御を受けない)遺伝子の多くには、プロモーター上にG-box配列ではない5’-NNCGTG-3’が存在しています。ブラシノステロイド情報伝達を担うBZRファミリー転写因子はbHLHファミリー転写因子と共通の塩基認識モチーフを有しながら、非典型な二量体形成様式をとることにより、bHLHファミリー転写因子が認識する遺伝子プロモーターだけでなく、bHLHファミリー転写因子が認識しづらい遺伝子プロモーターへの認識も可能にしていると推測されます(図1)。
本研究で明らかにしたBZRファミリー転写因子のDNA認識特異性の分子メカニズムは、ブラシノステロイド応答遺伝子の多様さを生み出す仕組みそのものであるといえ、多様な生理機能を制御するブラシノステロイド情報伝達の理解に大きく貢献する知見と考えられます。また、「似て非なる二種類の転写因子における塩基配列認識の厳密さの違い」を生み出す構造基盤の理解は、転写因子や遺伝子プロモーター等の人工改変を通じた有用形質を示す植物の創出にも繋がることが期待されます。
本研究は、日本学術振興会(JSPS)「新学術領域研究」、文部科学省「創薬等支援技術プラットフォーム事業(PDIS)」及び「創薬等先端技術支援基盤プラットフォーム(BINDS)」、科学技術振興機構(JST)「CREST」の支援を受けて行われました。
発表雑誌
- 雑誌名
- :
「Nature Plants」
- 論文タイトル
- :Structural basis for brassinosteroid response by BIL1/BZR1
(BIL1/BZR1によるブラスノステロイド応答の構造基盤) - 著者
- :Shohei Nosaki, Takuya Miyakawa, Yuqun Xu, Akira Nakamura, Kei Hirabayashi, Tadao Asami, Takeshi Nakano, and Masaru Tanokura*
- DOI番号
- :10.1038/s41477-018-0255-1
- 論文URL
- :https://www.nature.com/articles/s41477-018-0255-1
問い合わせ先
特任教授 田之倉 優(たのくら まさる)
Tel:03-5841-5165
Faxl:03-5841-8023
E-mail:amtanok<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
東京大学大学院農学生命科学研究科 応用生命化学専攻 養生訓を科学する医食農連携寄付講座
特任准教授 宮川 拓也(みやかわ たくや)
Tel:03-5841-2283
Faxl:03-5841-2283
E-mail:atmiya<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 植物ホルモン
- 多くの植物に普遍的に存在しており、植物自身の体内で生産され微量で自らの生長等の生理機能を調節する作用を示す低分子量有機化合物
- 注2 bHLHファミリー転写因子
- bHLHは塩基性(basic)ヘリックス-ループ-ヘリックス(helix-loop-helix)の略称であり、DNA結合領域である塩基性領域と二量体形成に係わるHLH領域から構成され、特有の立体構造を共通してもつ一群の転写因子です。bHLHファミリー転写因子はあらゆる真核生物に存在し、各々の生物の発生・分化に関わる重要な局面で関連遺伝子の制御を担っています。
- 注3 X線結晶構造解析法
- タンパク質、DNA等の核酸、またはそれらが複数結合した複合体を適した溶液組成・温度等の条件下で徐々に析出させていくと、分子が規則正しく並んだ結晶が形成します。X線結晶構造解析法は、結晶にX線を照射して得られるX線回折像を解析することで、生体分子の三次元構造を決定する方法です。