| 2009/10/27 |
|
発表者:入沢正人(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士課程)
井上順 (東京大学大学院農学生命科学研究科 応用生命化学専攻 助教)
小澤のぞみ(東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程)
森和俊(京都大学大学院理学研究科 教授)
佐藤隆一郎(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
発表概要
メタボリックシンドローム、脂質異常症の原因は脂質代謝恒常性の破綻に起因しており、その中心で機能する転写因子(注1)SREBPの機能不全が深く関与する。本研究において、SREBP活性化を調節する新たな小胞体膜タンパク質TRC8を見いだし、その機能解析を行った。これら疾病の予防・治療の基礎知見として、有用な情報を提示している。
発表内容
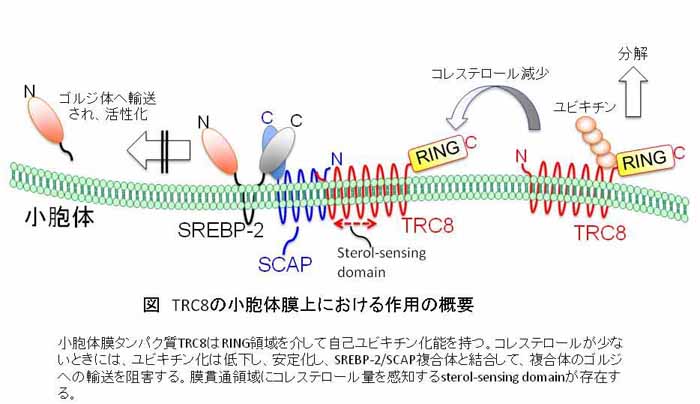
肝臓における脂肪酸、コレステロール代謝は合成酵素等の遺伝子発現を転写因子SREBPが調節することにより恒常性が維持されている。例えば、摂食後の血糖値上昇に引き続いておこるインスリン分泌に呼応して、肝臓ではSREBP-1cの発現上昇、活性化により、その応答遺伝子である脂肪酸、トリグリセリド合成酵素群が上昇し、摂取エネルギーは脂肪として蓄えられる。SREBPには、構造の酷似したSREBP-1とSREBP-2が存在し、それぞれ脂肪酸代謝、コレステロール代謝を制御している。いずれの因子も小胞体膜タンパク質として合成された後に、同じく膜タンパク質のSCAPと複合体を形成する。小胞体のコレステロール量が低下すると、複合体はゴルジへと輸送され、活性を持つN末端が切断され、核へと移行し、転写因子として応答遺伝子発現を調節する。この調節を主に受けるのは、コレステロール代謝に関与するSREBP-2であり、SREBP-1は異なる制御を受ける必要があるが、不明な点が多く山積している。今回、我々は、SREBP-2に特に強い結合能を持ち、SREBP-2/SCAP複合体(注2)の小胞体からゴルジへの輸送を阻害して、転写因子としての活性化を負に制御する新たな膜タンパク質TRC8の機能を明らかにした。TRC8は、がん抑制因子として見いだされたがその機能は不明な点が多いタンパク質で、N末端側の膜貫通領域にはステロールセンシング領域(注3)を有し、C末端側にはユビキチン化(注4)酵素E3活性を持つRING finger domainが存在する。今回の解析から、ステロールセンシング領域を介して、コレステロール量を感知し、コレステロールが減少すると、自己ユビキチン化を低下させ、安定化し、SREBP-2/SCAP複合体の輸送を阻害する機能を発揮することが明らかとなった。これまでも小胞体膜上での活性化調節が提唱されてきたが、今回の新たな因子TRC8による調節機構は、SREBP-1とSREBP-2の活性をそれぞれ制御する分子機構の理解に重要であると同時に、脂肪酸代謝とコレステロール代謝を個別に制御することを目的とした創薬の新たな標的として注目することができる。
添付資料
発表雑誌
問い合わせ先
教授 佐藤隆一郎
Tel: 03-5841-5136
FAX: 03-5841-8029
E-mail: aroysato@mail.ecc.u-tokuyo.ac.jp
用語解説
注1 転写因子:核の中において遺伝子発現を調節する機能を持つタンパク質。この作用により、エネルギー・脂質代謝関連酵素等の発現が増減して、代謝調節が執り行われる。
注2 SREBP-2/SCAP複合体:SREBPは単独では小胞体膜上から移動することはできず、SCAPと複合体を形成したのちに、SCAPを認識する機構が働いて、小胞体からゴルジへと輸送される。ゴルジにおいて2種類の切断酵素によりSREBPは切断を受け、N末端が活性型として核へ移行し、転写因子として作用する。従って、小胞体-ゴルジ輸送が活性化にとって重要かつ必須となっている。
注3 ステロールセンシング領域(sterol-sensing domain):膜中のコレステロールと結合し、構造を変化させる膜貫通領域。コレステロール合成の律速酵素HMG CoA還元酵素、SCAP等の膜貫通領域にも存在する。どのような機構でコレステロールを結合し、構造変化するなどについては不明な点が多い。
注4 ユビキチン化:ユビキチンは76アミノ酸からなるポリペプチドで、RING finger domain等を有したユビキチンリガーゼ(E3酵素)の働きで固有のタンパク質に結合する。このユビキチンに別のユビキチンが結合して、ポリユビキチン鎖が形成されると、この分子はプロテアソームにより認識され、速やかな分解を受ける。
〒113−8657 東京都文京区弥生1−1−1 www-admin@www.a.u-tokyo.ac.jp
Copyright © 1996- Graduate School of Agricultural and Life Sciences, The University of Tokyo