東京大学大学院 農学生命科学研究科 研究成果
好熱菌ホモクエン酸合成酵素の基質認識機構とフィードバック阻害機構の解明
- 発表者
- 岡田 卓也 (東京大学生物生産工学研究センター/大学院農学生命科学研究科応用生命工学専攻・修士課程)
富田 武郎 (東京大学生物生産工学研究センター・助教)
Asri Peni Wulandari (東京大学生物生産工学研究センター;現パジャジャラン大学、インドネシア)
葛山 智久 (東京大学生物生産工学研究センター・准教授)
西山 真 (東京大学生物生産工学研究センター・教授)
発表概要
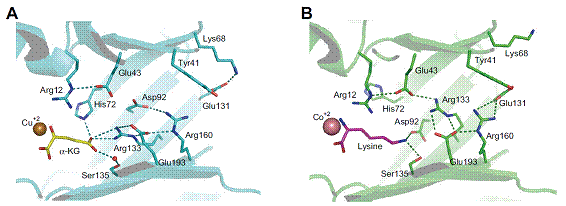
好熱菌[注1]のリジン生合成の初発酵素であるホモクエン酸合成酵素の立体構造を明らかにし、基質認識機構とフィードバック阻害機構を解明した。性質の大きく異なる基質と阻害剤が酵素の同一サイトで認識されるというユニークな競合阻害様式が明らかになった。本研究成果は、アミノ酸等の高生産系の構築につながるものと期待される。
発表内容
リジン生合成には、アスパラギン酸を初発物質としてジアミノピメリン酸を経由する経路と、α-ケトグルタル酸を初発物質としてα-アミノジピン酸(AAA)を経由する経路が知られている。前者は細菌や植物に分布しており、近年需要が増えているリジンの発酵生産では初発酵素であるアスパラギン酸キナーゼのフィードバック耐性変異酵素を有するCorynebacterium glutamicumが用いられている。一方、後者はカビや酵母に分布しているが、好熱菌Thermus thermophilusはAAAを経由する経路でリジンを生合成する。T. thermophilusではリジン生合成の初発酵素ホモクエン酸合成酵素がリジンによる競合阻害を受けることでリジンの合成量が調節されるが、その機構はわかっていなかった。東京大学生物生産工学研究センターの西山教授のグループは、HCSの立体構造を大学共同利用機関法人高エネルギー加速器研究機構の物質構造科学研究所放射光科学研究施設を用いて、X線結晶構造解析により明らかにした。その結果、α-ケトグルタル酸やホモクエン酸の結合した立体構造から、HCSがこれらを認識する仕組みが明らかとなった。さらにリジンの結合した立体構造ではリジンはα-ケトグルタル酸と同じ位置に結合していた。α-ケトグルタル酸が末端部分に負電荷を有するのに対し、リジンは末端部分に正電荷を有する構造となっている。これらを同じ位置で認識するためにHCSは酵素内部の多数のアミノ酸残基の配置を変化させていることが明らかになった(図1)。この仕組みが明らかになったことにより、高活性なフィードバック阻害耐性の変異酵素をデザインすることが可能になったといえる。そのような変異酵素を生合成系へ組み込むことでリジンだけでなく生合成中間体であり抗生物質の生合成中間体でもあるAAAの発酵生産系の構築が期待される。
発表雑誌
タイトル: Mechanism of substrate recognition and insight into feedback inhibition of homocitrate synthase from Thermus thermophilus
著者: 上記発表者と同一
問い合わせ先
教授 西山 真
Tel: 03-5841-3074
Fax: 03-5841-8030
E-mail: umanis@mail.ecc.u-tokyo.ac.jp