東京大学大学院 農学生命科学研究科 研究成果
ヒト苦味受容体におけるリガンド結合様式の解明
- 発表者
- 櫻井 敬展 (東京大学大学院農学生命科学研究科応用生命化学専攻・受託研究員)
三坂 巧 (東京大学大学院農学生命科学研究科応用生命化学専攻・准教授)
石黒 正路 (新潟薬科大学応用生命科学部・教授)
益田 勝吉 (新潟薬科大学応用生命科学部・研究員)
菅原 大嗣 (東京大学大学院農学生命科学研究科応用生命化学専攻・修士課程(当時))
伊藤 圭祐 (日本学術振興会特別研究員(当時))
小林 拓也 (京都大学大学院医学研究科・講師)
松尾 伸二 (日清食品ホールディングス株式会社)
石丸 喜朗 (東京大学大学院農学生命科学研究科応用生命化学専攻・特任助教)
朝倉 富子 (東京大学大学院農学生命科学研究科応用生命化学専攻・特任准教授)
阿部 啓子 (東京大学大学院農学生命科学研究科応用生命化学専攻・特任教授)
発表概要
苦味を呈する物質がどのように苦味受容体(注1)に認識されているかについて、構造学的な面からはほとんど明らかにされていなかった。今回、ヒト苦味受容体の1種類hTAS2R16について、苦味物質の結合様式を明らかにすることができた。
発表内容
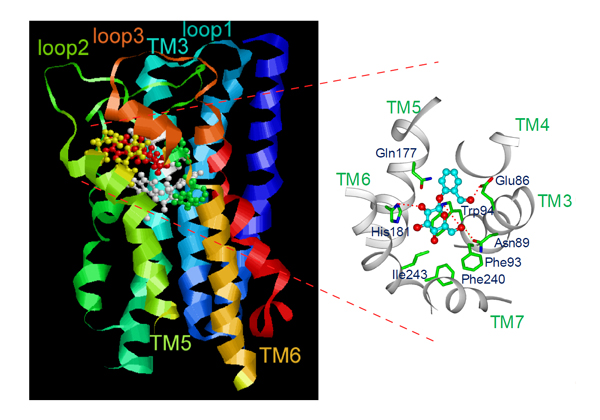
図:本研究において特定されたhTAS2R16のリガンド認識構造
(左)受容体を横から見た構造を示し、細胞外領域が上、細胞内領域が下となるように配置している。細胞外に近い膜貫通領域に囲まれた部分において、リガンドであるサリシンと結合している。
(右)リガンド結合部位の拡大図。膜貫通領域に存在する複数のアミノ酸残基が、リガンド認識に関与していることが示された。
Gタンパク質共役型受容体は7回膜貫通領域を持つタンパク質で、その種類はヒトでは1000を超える。これら受容体は様々な物質に対するセンサーとして機能している。視覚・嗅覚・味覚といった感覚の発信においてもGタンパク質共役型受容体が関与しており、味物質受容においては甘味・旨味・苦味物質の受容体が、Gタンパク質共役型受容体である。
人間において苦味を感じる物質は数多く存在するにもかかわらず、TAS2Rファミリーに属するたった25種類の苦味受容体でそれら苦味物質を受容している。それぞれの苦味受容体がどのような物質に対応するかの知見は蓄積されてきてはいるものの、その認識に関する構造生物学的な知見は、これまでほとんどなかった。
本研究においては、分子シミュレーションによる受容体の苦味物質(リガンド)認識構造の予測と、点変異を導入した苦味受容体におけるリガンド受容能評価を組み合わせることによって、ヒト苦味受容体の1種類であるhTAS2R16について、苦味物質の受容様式を明らかにすることができた。まずhTAS2R16の受容体構造を、視覚受容体であるロドプシンの活性化型構造をもとにシミュレーションした。次いで、リガンドであるサリシンとの結合構造を分子動力学計算により予測した。その結果、膜貫通領域に囲まれた部分にリガンド結合部位の存在が予想され、リガンド認識に深く関わる受容体側のアミノ酸残基を8か所予測することができた。それぞれのアミノ酸残基を、他のアミノ酸残基に変えた点変異導入受容体におけるサリシン受容能を実験的に評価したところ、構築したモデルから予想されたものとほぼ一致する結果を得ることができたことから、hTAS2R16のリガンド認識構造を特定することができた(図)。
お茶、コーヒー、ビールなどの食品においては、苦味はそれぞれを特徴づける主要な味である。しかし苦味の強すぎる食品は一般に嫌われることから、苦味強度を調節することは、食品産業にとって大きな問題となっている。本研究で明らかになった苦味物質の認識機構を利用することで、有用な苦味抑制剤の分子設計が可能になると期待される。
発表雑誌
Characterization of the beta-D-glucopyranoside binding site of the human bitter taste receptor hTAS2R16.
Sakurai T, Misaka T, Ishiguro M, Masuda K, Sugawara T, Ito K, Kobayashi T, Matsuo S, Ishimaru Y, Asakura T, and Abe K.
問い合わせ先
生物機能開発化学研究室
三坂 巧 准教授
Tel: 03-5841-8100
E-mail: amisaka@mail.ecc.u-tokyo.ac.jp
ホームページ: http://park.itc.u-tokyo.ac.jp/biofunc/