東京大学大学院 農学生命科学研究科 研究成果
リジン発酵生産の鍵酵素であるアスパラギン酸キナーゼの活性制御機構の解明
- 発表者
- 吉田 彩子 (東京大学生物生産工学研究センター/大学院農学生命科学研究科応用生命工学専攻・博士課程)
富田 武郎 (東京大学生物生産工学研究センター・助教)
葛山 智久 (東京大学生物生産工学研究センター・准教授)
西山 真 (東京大学生物生産工学研究センター・教授)
発表概要
工業的リジン発酵生産に利用されるCorynebacterium glutamicumのリジン生合成系初発酵素であり鍵酵素であるアスパラギン酸キナーゼの立体構造を決定し、長年の謎であったアロステリックなフィードバック阻害機構を明らかにした。本研究成果により、より効率的なリジン生産系の構築につながることが期待できる。
発表内容
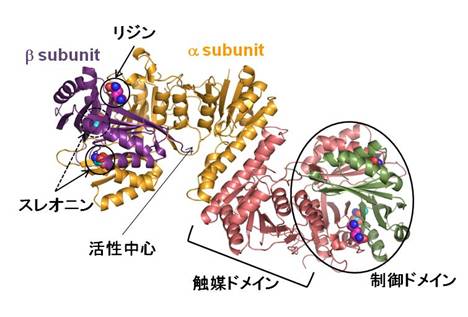
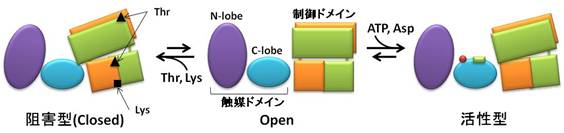
リジンはヒトなどの高等動物において必須アミノ酸であり、家畜肥料への添加物として大量に用いられている。このリジンはアミノ酸発酵菌(注1)であるCorynebacterium glutamicum(注2)を用いた発酵法によって生産されている。一般にアミノ酸生合成系ではその生産量を調節するために、最終産物によって経路の初発酵素がフィードバック阻害(注3)を受けることがよく知られている。このC. glutamicumのリジン生合成経路においても初発酵素であるアスパラギン酸キナーゼ(AK)が最終産物であるリジンとスレオニンが共に高濃度存在するときにフィードバック阻害を受けることが知られている。工業的なリジン発酵生産においてはこのフィードバック阻害耐性変異株が用いられているが、その阻害メカニズムは約40年もの間謎であった。そこで我々の研究グループでは、大学共同利用機関法人高エネルギー加速器研究機構のPhoton Factory (PF)を用いて、C. glutamicum由来のAK (CgAK)の立体構造をX線結晶構造解析により決定した。その結果、阻害剤であるリジンとスレオニンを結合した阻害型の結晶構造(図1)から、それらの結合部位が活性中心とは離れた制御ドメインにあることが明らかとなった。また、スレオニンのみが結合した活性型との比較により、リジンの結合によって触媒ドメインと制御ドメインとの間の結合が生じ、基質の結合ができない“閉じた”構造が安定化され、不活性型となるというフィードバック阻害メカニズムが示唆された。また、フィードバック阻害耐性変異体の結晶構造の決定にも成功し、構造の比較から、リジンとスレオニンを結合しても“閉じた”構造を安定化できなくなることが示唆され、フィードバック阻害耐性メカニズムを明らかにすることができた(図2)。この研究成果によってCgAKの制御メカニズムが明らかになるとともに、フィードバック阻害耐性変異酵素をデザインすることが可能になり、より効率的なリジン生産の実現が期待される。
 |
 |
| 図1 | 図2 |
発表雑誌
(2010年6月23日電子版掲載、2010年8月27日刊行)
Mechanism of concerted inhibition of α2β2-type hetero-oligomeric aspartate kinase from Corynebacterium glutamicum.
Ayako Yoshida, Takeo Tomita, Tomohisa Kuzuyama, and Makoto Nishiyama
問い合わせ先
西山 真 教授
Tel: 03-5841-3074
Fax: 03-5841-8030
E-mail: umanis@mail.ecc.u-tokyo.ac.jp
用語解説
微生物の生体内の反応を利用して、グルコースなどの栄養源からアミノ酸を生産する方法。より効率的な生産系のためにアミノ酸高生産変異株が用いられる。
注2 Corynebacterium glutamicum:グラム陽性の桿菌であり、1950年代に日本においてグルタミン酸高生産菌として単離された。現在ではグルタミン酸をはじめとするアミノ酸発酵菌として用いられる工業的に重要な細菌の一つである。
注3 フィードバック阻害:ある代謝系において、その生産物の量を調節するため、代謝系の初発段階や分岐点を触媒する酵素活性が、生産物によって制御される現象。アミノ酸発酵においては生産物を過剰に得るため、フィードバック阻害耐性変異株が用いられる。