東京大学大学院 農学生命科学研究科 研究成果
グルコース/グルクロン酸交互共重合体多糖の調製法を開発
- 発表者
- 廣田 真之 (東京大学大学院農学生命科学研究科 生物材料科学専攻・修士課程)
降旗 一夫 (東京大学大学院農学生命科学研究科 核磁気共鳴施設・助教)
齋藤 継之 (東京大学大学院農学生命科学研究科 生物材料科学専攻・助教)
川田 俊成 (京都府立大学大学院生命環境科学研究科 環境科学専攻・准教授)
磯貝 明 (東京大学大学院農学生命科学研究科 生物材料科学専攻・教授)
発表概要
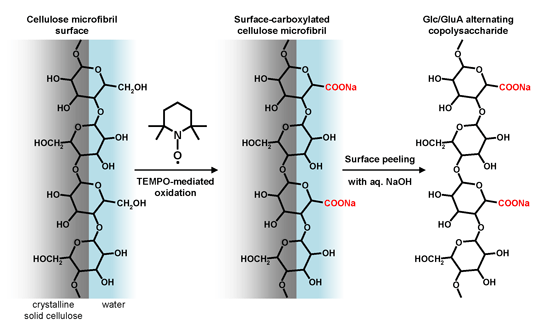
グルコースとグルクロン酸が交互に(1→4)-β-グリコシド結合した新規水溶性多糖を調製する方法を、セルロースミクロフィブリル(注1)のTEMPO触媒酸化(注2)とその表面剥離処理により開発した。ヒアルロン酸同様、生理活性多糖等としての機能が期待できる。
発表内容
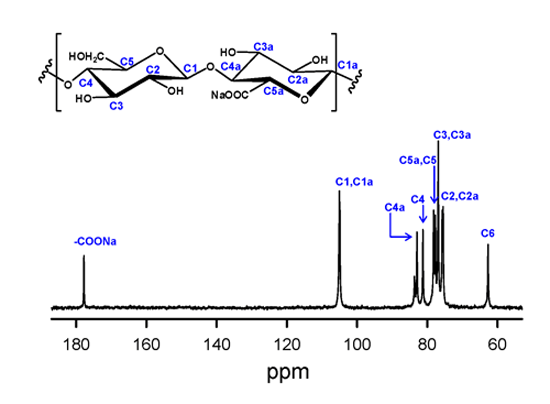
動植物中の天然セルロースは、幅3-10nmで高結晶性のミクロフィブリルをエレメントとして階層構造および複合体を形成して生体を支えている。樹木およびホヤ由来の天然セルロースを水系媒体でTEMPO触媒酸化することにより、そのミクロフィブリル表面に露出しているC6位の1級水酸基のみを選択的に、しかも全てカルボキシル基に変換することを見出した(Okita et al., Biomacromolecules, 2010, 11, 1696-1700)。そこで、TEMPO酸化天然セルロースを水中解繊処理して完全ナノ分散させ、アルカリ水溶液で処理することで、TEMPO酸化セルロースナノファイバーの表面を選択的に剥離させることにより、グルコースとグルクロン酸が交互に(1→4)-β-グリコシド結合した新規水溶性多糖が得られることを見出した(図1)。TEMPO酸化セルロースナノファイバーが水中で完全ナノ分散しているかどうかは、透明水分散液の偏光性発現で判断できる(図2)。得られた水溶性多糖の13C-NMRスペクトルを図3に示す。C6とCOONaの2本、C4とC4aの2本のシグナル強度がそれぞれほぼ等しいことから交互共重合体多糖(注3)であることを示唆しているが、その証明は、Constant-time heteronuclear multiplebond correlation analysis(CT-HMBC)等のロングレンジNMR相関解析と全NMRシグナルの帰属によって行った。今回の発見は、異なる起源の天然セルロースの結晶性ミクロフィブリルの表面ナノ固体構造の差異を明らかにする上で重要な手法となるばかりではなく、新しい交互共重合体多糖合成ルートの開発、ヒアルロン酸同様の新規の生理活性多糖としての機能発現が期待できる。
 |
 |
| 図2 | 図3 |
発表雑誌
問い合わせ先
磯貝 明 教授
Tel: 03-5841-5538
Fax: 03-5841-5269
E-mail: aisogai@mail.ecc.u-tokyo.ac.jp
用語解説
天然セルロースが形成している階層構造のうち、セルロース分子に次ぐ最小構成エレメントで、樹木の場合には幅約4nmと超極細(セルロース分子約40本分)、結晶化度70%以上、長さ数ミクロン以上のバイオナノファイバー。TEMPO触媒酸化によって初めて完全ナノ分散が可能となった。
注2 TEMPO触媒酸化:TEMPOは2,2,6,6-テトラメチルピペリジニル-1-オキシラジカルの略で、水溶性の安定ニトロキシルラジカル。水系TEMPO触媒酸化により、多糖のC6位の1級水酸基を選択的にカルボキシル基に変換できることを見出している。また、天然セルロースのTEMPO触媒酸化により、新規バイオ系ナノファイバーが得られ、そのフィルムは透明で高酸素バリア性、低線熱膨張率、高強度高弾性率となる。
注3 交互共重合体多糖:異なった二種類の単糖が交互に結合した多糖。天然多糖ではヒアルロン酸が知られている。モノマーあるいはダイマーからの合成も試みられているが、多段階の反応および単離精製処理を要し、しかも高分子量にはならない。今回は天然セルロースのTEMPO触媒酸化と、そのナノファイバー表面の選択的剥離という全く新しいルートでの調製が可能となった。