はじめに
一つの生物が持つ遺伝情報全体のことをゲノムと呼びます。ヒトにはヒトゲノム、大腸菌には大腸菌ゲノムといったように、生物の多様性は固有のゲノムによっています。これまでに数百種類のモデル生物のゲノムが解読されています。単細胞生物の代表として大腸菌ゲノムは約460万塩基対であるのに対して、哺乳類ではマウスゲノム約25億塩基対、ヒトゲノム約32億塩基対と、ゲノムサイズが1,000倍も大きくなっています。ゲノムはおよそ35億年もの長い時間をかけて変化し、生物の多様性を生み出してきました。哺乳類は多数の遺伝子から成り立っていますが、進化の過程でゲノム全体が増幅し、同じ遺伝子が2倍あるいは4倍・・・と増えてきたと考えられています。
面白い遺伝子の増え方のひとつに、遺伝子Aが増えてA’となり、さらに増えてA”となるような遺伝子増幅があります。元の遺伝子Aが存在しているため、増幅したA’やA”は塩基配列が少しずつ変化してAとは異なる機能を持つことになります。A、A’、A”・・・の塩基配列はそれぞれ似ており、このようにして増えていく遺伝子をまとめて遺伝子ファミリーと呼びます。遺伝子ファミリーとして沢山の遺伝子セットが備わっていることが哺乳類ゲノムのひとつの特徴です。各ファミリーメンバーの遺伝子は、必ずしも同じ細胞で発現しているわけではありません。たとえば、ヒトやマウスに見られるプロラクチンというホルモンの遺伝子は脳の下垂体だけで発現しますが、プロラクチンファミリーを構成する他のメンバーは、主に胎盤で発現しています。
ファミリーをつくる遺伝子に、どのような進化のメカニズムが関わっているのかは大きな疑問のひとつです。進化の途上でヒトとマウスが分かれたのは約7,500万年前、ラットとマウスが分かれたのが1,200‐2,400万年前です(図1)。生命の誕生が約35億年前ですから、それに比べると、ヒトとマウスやラットとの分岐はつい最近の出来事です。哺乳類のモデル生物として最も多く使用されているマウスの、特に種間における違いが大きいプロラクチン遺伝子ファミリーについて研究することで、つい最近の進化上の出来事を知ることが可能です。下記の研究で、DNAメチル化(注1)が遺伝子の多様性を生む原因であることが分かってきました。
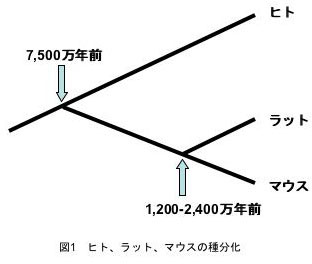
図1 ヒト、ラット、マウスの種分化 (拡大画像↗)
発表概要
東京大学大学院農学生命科学研究科の塩田邦郎教授らの研究グループでは、ホルモンのひとつプロラクチンのスーパーファミリーを構成する24の遺伝子についてDNA配列とDNAメチル化状態を解析したところ、それらが4つのグループに分類され、グループごとに組織特異的メチル化領域を持ち、かつ組織特異的な発現をしていること、さらには、メチル化シトシンの脱アミノ化によるチミンへの転換を通じてゲノム変異を引き起こすことで、プロラクチンスーパーファミリーのメンバーを増やしてきた可能性があることを、マウスにおいて見出しました。
この結果は、DNAのメチル化がゲノムDNA配列の多様化とそれらの組織特異的発現とのかけ橋になることで、生物の進化をバックアップしてきた可能性があることを示唆するものです。哺乳類に広く存在するDNAメチル化機構が、遺伝子発現の制御やゲノム安定性のほかに担う新たなる役割として、ひいては哺乳類のゲノム進化を解明していくうえでの新たなる観点となることが大いに期待されます。
発表内容
現在、生物が進化するための基本的な背景には、あらゆる生物を形作る遺伝物質であるDNAに変化が起きることで新たな機能やメカニズムを獲得してきたことがあると主に考えられています。DNAの変化とは塩基(アデニン‐A; チミン‐T; グアニン‐G; シトシン‐C)配列の変化であり、そこには遺伝子DNAのコピー数の変化も含まれます。DNA変化の結果、現存する生物には共通の祖先に由来すると考えられるDNA配列以外に、それと似通った遺伝子群=遺伝子ファミリーが多数存在しています。遺伝子ファミリーの系統的な解析は、逆に、生物の進化の痕跡をたどる手段のひとつとなっています。
エピジェネティック機構(注2)のひとつのDNAメチル化は、哺乳類において組織特異的な遺伝子発現の調整にかかわっていることがこれまでの研究で明らかにされています。DNAを構成する4つの塩基のなかで、シトシン(C)とグアニン(G)が隣り合う配列(CpG配列)のシトシンがメチル化されると、それが目印となって様々な分子が集まり、結果、遺伝子の転写が抑制されます。
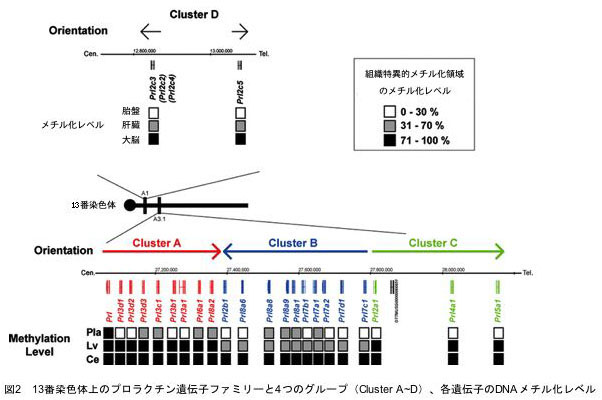
マウスにおいて、24の遺伝子からなるプロラクチン遺伝子ファミリーは13番染色体上の1Mbという範囲の中に収まっており、それらは、ゲノム上の位置から4つのグループに分けられました(図2)。面白いことに、24のメンバー全てが例外無く、遺伝子発現していない組織ではメチル化されていることが明らかになりました。そして、DNAメチル化状態は各グループで共通しており、それぞれが組織特異的な発現に関係していることが明らかになりました。このことは、DNAメチル化による遺伝子の発現制御は各遺伝子が個別に受けているのではなく、グループとして制御されていることを示しています。
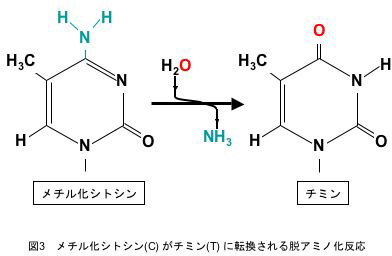
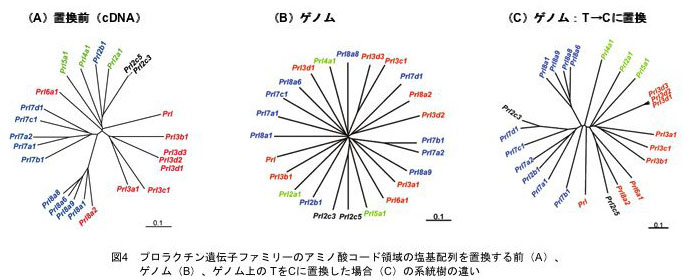
さらに興味深いことは、CpG配列の数が24の各遺伝子間で大きく異なっていることでした。これは祖先の遺伝子から変化した(変異した)結果だと考えざるをえません。上記のように、メチル化されたシトシン(C)は自然に起こる脱アミノ化というアクシデントにより、チミン(T)へと転換されることが知られています(図3)。そこで、マウスのプロラクチン遺伝子ファミリーでは、進化の過程で、DNAメチル化が引き金となりゲノムCpG数の減少が起きたのではないかと考え、同遺伝子ファミリーの配列を、T⇒Cに置換して塩基配列を再構成して分子系統樹を描いてみました(図4)。これまでの分子系統樹はアミノ酸に置換されるコード領域のデータのみによるもので、その場合、系統樹は先の4つのグループに関係なくバラバラに描かれる結果となっていました。しかし、驚いたことに、T⇒Cに塩基配列を置換したデータを用いると、4グループが矛盾なく系統樹を造りあげることが明らかになったのです。
このことは、遺伝子ファミリーのゲノムの進化にDNAメチル化が、①遺伝子配列の多様性と、②組織特異的発現、の両方に機能していることを示しています。DNAメチル化が起きるのはコピー数の増加によることは実験的に示されているので、コピー数増加(祖先)⇒DNAメチル化⇒遺伝子の変異(T⇒C)と組織特異的発現(マウス)、という図式が浮かび上がりました。エピジェネティクスが哺乳類の進化に寄与してきた可能性を強く示すものです。今後、哺乳類の進化を研究していくうえでDNAメチル化が新たな切り口となっていくことが期待されます。
(文部科学省科学研究費基盤研究(S)2122008)発表雑誌
- 雑誌名
- 「Mammalian Genome」(12月22日オンライン版)
- 論文タイトル
- Bridging sequence diversity and tissue-specific expression by DNA methylation in genes of the mouse prolactin superfamily.
- 著者
- Koji Hayakawa, Momo O. Nakanishi, Jun Ohgane, Satoshi Tanaka, Mitsuko Hirosawa, Michael J. Soares, Shintaro Yagi and Kunio Shiota
- DOI
- 10.1007/s00335-011-9383-x
- アブストラクト
- http://www.springerlink.com/content/m818815277h45160/
問い合わせ先
東京大学大学院農学生命科学研究科 応用動物科学専攻 細胞生化学研究室
教授 塩田 邦郎 (しおた くにお)
Tel: 03-5841-5472
Fax: 03-5841-8189
用語解説
- (注1) DNAメチル化
- シトシンの5位にメチル基が付加されることでDNAがメチル化されること。遺伝子の発現制御、胚発生や細胞分化に重要な役割をもつ。
- (注2) エピジェネティック機構
- DNAの塩基配列の変化を伴わずに細胞分裂後も継承されるメカニズムをエピジェネティクスといい、DNAメチル化、ヒストン修飾などがエピジェネティクスを制御する機構としてしられている。