発表概要
甘味を示す化合物は糖・アミノ酸・人工甘味料など、その化学的構造が非常に多様であるにもかかわらず、たった一つのヒト甘味受容体により受容される。これらの多様な甘味物質群をヒト甘味受容体がどのように識別しているのかについて、不明な点が多かった。本研究では、人工甘味料として用いられている低分子甘味物質群を用いて、構造の異なる甘味物質をヒト甘味受容体がどのようにして識別しているのかについて明らかにした。甘味物質の認識に関わる受容体側アミノ酸残基を複数突き止め、ヒト甘味受容体がそれらを巧妙に使い分けることにより、化学的性質の異なる多種類の低分子甘味物質を受容していることを明らかにした。
本研究は、財団法人サントリー生物有機科学研究所、東京大学、新潟薬科大学との共同研究として行われた。
発表内容
ヒトが甘味を感じる物質は数多い。砂糖をはじめとする糖類以外にも、グリシンやD-トリプトファンなどのアミノ酸、アスパルテームなどの人工甘味料、モネリンなどの甘味タンパク質など、様々な物質がその例である。これらの物質は甘いという共通点はあるものの、分子量やその他化学的性質は大きく異なっている(図1)。一方で、甘味物質を口腔内で受容するヒト甘味受容体(注1)は1種類しか存在せず、この受容体が多数の甘味物質により活性化されることも明らかにされてきた。しかし、多様な構造を持つ甘味物質群をどのように識別しているのかについては、不明な点が多く残されていた。
本研究においては、分子シミュレーションによる受容体の甘味物質識構造の予測と、点変異導入(注2)ヒト甘味受容体における受容能評価により、ヒト甘味受容体における低分子甘味物質群の認識機構を明らかにすることができた。まず、ヒト甘味受容体の構造を、代謝型グルタミン酸受容体の活性化型構造をもとにシミュレーションした。次いで、リガンド(注3)である低分子甘味物質群との結合構造を分子動力学計算により予測し、リガンド認識に深く関わる受容体側のアミノ酸残基を10か所予測することができた。さらに、これらについて点変異導入受容体を作製して甘味物質への応答性を調べたところ、変異導入により甘味物質に対する応答性が低下したことから、これら10残基が低分子甘味物質の認識に強く関与することが明らかになった。この10残基は、受容体の細胞外の一定の領域内に存在するものの、低分子甘味物質の化学的性質によって認識に必要なアミノ酸残基が異なることが判明した(図2)。さらに、活性型受容体と甘味物質との結合モデルを構築することで、甘味受容体がリガンド受容ポケット中のアミノ酸残基を巧妙に使い分け、化学的性質の異なる多種類の低分子甘味物質を受容している様子が明らかになった(図3)。
以上より、たった一つのヒト甘味受容体が、多種類の低分子甘味物質を受容できる謎が解明できたといえる。ところで、甘味受容体は口腔内以外にも、消化管、膵臓など、消化やエネルギー恒常性に関わる器官にも発現し、生体内における血糖値のセンサーの役割にも関わっていることが最近報告された。低分子甘味物質がどのようにして甘味受容体に認識されるかを明らかにした今回の研究成果は、新規人工甘味料の開発のみならず、糖尿病治療薬のデザインといった方面にも有効に活用されることが期待され、“味覚と健康”という新しい領域が拓かれつつある。
なお本研究は、生物系産業創出のための異分野融合研究支援事業、および科学研究費補助金(特別研究員奨励費、研究活動スタート支援、基盤研究(B)、若手研究(A)、挑戦的萌芽研究)からの研究費を受けて行われた。
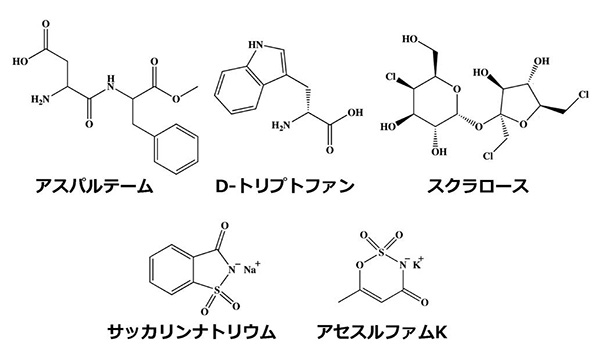
図1 甘味を示す低分子化合物群 (拡大画像↗)
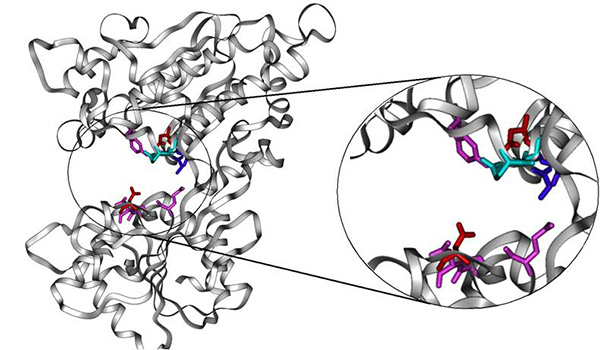
図2 甘味受容体における低分子甘味物質のリガンド認識に関与する領域
ヒト甘味受容体のhT1R2サブユニットの細胞外領域モデルにおいて、低分子甘味物質の認識に強く関与する10残基を表示した。低分子甘味物質の化学的性質によって、認識に必要なアミノ酸残基が異なることが判明し、各残基の機能分類を色で示した。 (拡大画像↗)
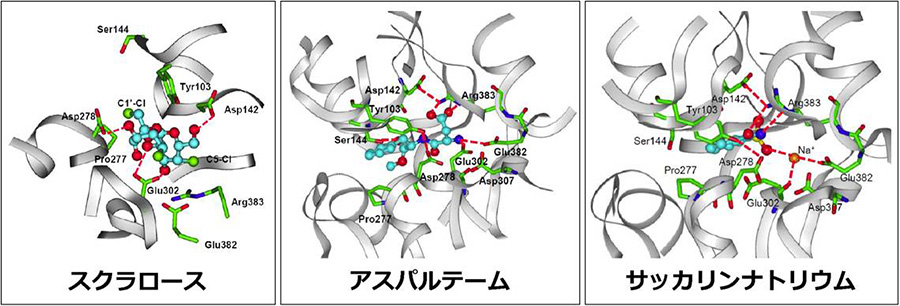
図3 活性型ヒト甘味受容体と人工甘味料との結合モデル
分子シミュレーションによって得られた、活性型ヒト甘味受容体と人工甘味料との結合モデルを示した。スクラロース・アスパルテーム・サッカリンナトリウムのような化学的性質の異なる人工甘味料の認識に、甘味受容体が異なるアミノ酸残基を巧妙に使い分けしている様子が示された。 (拡大画像↗)
発表雑誌
- 雑誌名
- PLoS One
- 掲載日
- 2012年4月20日 PLoS One , Vol. 7, e35380 (2012)
- 論文タイトル
- Characterization of the modes of binding between human sweet taste receptor and low-molecular-weight sweet compounds
- 著者
- Katsuyoshi Masuda#, Ayako Koizumi#, Ken-ichiro Nakajima, Takaharu Tanaka, Keiko Abe, Takumi Misaka*, and Masaji Ishiguro*
#: contributed equally to this work
*: corresponding authors - DOI番号
- doi:10.1371/journal.pone.0035380
問い合わせ先
東京大学大学院農学生命科学研究科
応用生命化学専攻 生物機能開発化学研究室
准教授 三坂 巧 (みさか たくみ)
Tel: 03-5841-8100
Fax: 03-5841-8118
E-mail: amisaka@mail.ecc.u-tokyo.ac.jp
新潟薬科大学 応用生命科学部 生物機能化学研究室
教授 石黒 正路 (いしぐろ まさじ)
Tel: 0250-25-5286
Fax: 0250-25-5021
E-mail: ishiguro@nupals.ac.jp
用語解説
- (注1) ヒト甘味受容体
- T1R2とT1R3という2種のタンパク質を構成成分とする受容体で、舌上皮に存在する味細胞に発現している。ヒトは1種類の甘味受容体(T1R2-T1R3)しか持っておらず、このたった1つの受容体で多種類の甘味物質を感知している。
- (注2) 点変異導入
- タンパク質は、20種類のアミノ酸がどういった順序で並んでいるかによって、機能が決定される。特定のアミノ酸残基を他のものに置換することを点変異導入と呼び、点変異導入によってタンパク質の役割が変化することを調べることで、その役割を推定することができる。
- (注3) リガンド
- 受容体に特異的に結合する物質であり、受容体と高い親和性を有する。