植物体内の様々な元素の動きを生きたまま可視化する技術の開発
- 発表者
-
菅野里美 (東京大学大学院農学生命科学研究科 附属放射性同位元素施設/応用生命化学専攻放射線植物生理学研究室 特任研究員(当時))
山脇正人 (東京大学大学院農学生命科学研究科 附属放射性同位元素施設/応用生命化学専攻放射線植物生理学研究室 特任研究員(当時))
石橋弘規 (東京大学大学院農学生命科学研究科 附属放射性同位元素施設/応用生命化学専攻放射線植物生理学研究室 特任研究員)
小林奈通子 (東京大学大学院農学生命科学研究科 附属放射性同位元素施設/応用生命化学専攻放射線植物生理学研究室 日本学術振興会特別研究員)
広瀬農 (東京大学大学院農学生命科学研究科 附属放射性同位元素施設/応用生命化学専攻放射線植物生理学研究室 特任研究員)
田野井慶太朗 (東京大学大学院農学生命科学研究科 附属放射性同位元素施設/応用生命化学専攻放射線植物生理学研究室 准教授)
Laurent Nussaume (CEA Cadarache, IBEB-SBVME Laboratory of Plant Development Biology, France)
中西友子 (東京大学大学院農学生命科学研究科 附属放射性同位元素施設/応用生命化学専攻放射線植物生理学研究室 教授)
発表概要
植物体内での元素の動きを可視化するために、現在まで多様な技術が開発されてきた。しかし、それらの技術の多くは分析に際して植物の破壊や暗所での撮影が必要であることが大きな難点であり、分析対象を制限する要因となってきた。そこで本研究では、植物体内の放射性同位体を高感度、高解像度に検出することで、生きた植物体内の無機元素動態をリアルタイムで可視化することを考え、新たな装置の開発を行った。これまでに、分析対象のスケールの違いに応じて使い分けられる、2種類の装置を開発することに成功した。これらの装置により、植物が土壌から無機元素を吸収し、地上部へ輸送するというマクロな動態から、根端部分に無機元素を蓄積するというミクロな動態までを、動画として捉えられるようになった。
発表内容
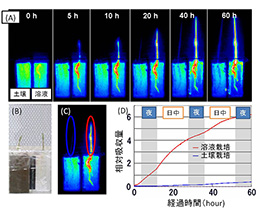
図1 イネによる32P-リン酸の吸収における、水溶液と土壌の違いをマクロシステムを用いて可視化した様子。(A)32P-リン酸を添加した水溶液あるいは土壌から、32P-リン酸が吸収される様子を、3分間に1回、60時間にわたって連続的に撮影した。各画像中、左側が土壌に植えたイネ、右側が水溶液に植えたイネ。(B) 供試植物の様子。(C) 撮影開始から60時間後の放射能分布像;楕円は、(D) で数値解析の対象としたエリアを示す。(D) 地上部から検出された放射能強度の経時変化。青線は土壌に植えられたイネ、赤線は水溶液に植えられたイネを示す。暗期を、灰色で示した。 (拡大画像↗)
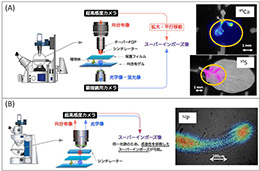
図2 ミクロシステムの仕様と、取得された画像。(A) テーパー型のファイバーを用いたFOSを搭載し、5倍ズームでの撮影が可能となった。根から45Ca-硫酸カルシウムを1時間吸収(右上)、あるいは35S-硫酸ナトリウムを48時間吸収(右下)した、播種後13日目のシロイヌナズナの地上部を示した。 (B) FOSと光学レンズを組み合わせることで、40倍ズームでの撮影を可能にした。図は32P-リン酸を吸収させた直後の根端のリン酸分布の様子。 (拡大画像↗)
可視化技術は、生命の生理活動を知るうえで今や欠かせない技術となっている。植物に応用されている技術のなかでも、開発が最も進んでいるのは蛍光を可視化するシステムである。しかし、撮像は暗所で行わなければならず、また、無機元素の検出には染色操作が必要な場合が多いことから、植物体内での無機元素動態をリアルタイムで可視化するという実験への応用が難しい。そこで本研究では、上記の問題点を克服する、植物用の放射線検出装置の開発を目指した。採用した検出原理は、植物体内の放射性同位元素から放出される放射線を、ファイバーオプティクプレートに蒸着したCsIシンチレーター(FOS)で光に変換し、その微弱な光をマルチチャネルプレートで増幅した上で高感度CCDカメラで検出するというものである。
マクロスケールでの解析では、10 cm × 20 cmの視野が捉えられ、シンチレーター表面を、放射線は通すが可視光は通さない厚さのアルミニウムで覆うことで、明条件下での連続撮影が可能となった。この装置(マクロシステム)を用いることで、イネが32Pで標識したリン酸を水耕液あるいは土壌から吸収し、地上部へ輸送する様子が動画として捉えられた。土壌に添加した32P-リン酸は植物にほとんど吸収されない一方、水耕液に添加した32P-リン酸は速やかに根に集まり、画像上に根の形が明瞭に映し出された。また、32P-リン酸の吸収は暗期(夜)よりも明期(昼)のほうが旺盛であることも分かった(図1)。開発した装置のもう一つの特徴は、解析対象となる放射性同位元素の種類が多いことである。市販のβ線放出核種としては14C、32P、33P、35S、45Caなどの他、X線放出核種である55Feや109Cdなども検出できる。
ミクロスケールでの解析用に開発した装置(ミクロシステム)では、前述の基本構造のうちテーパーFOSを採用することで拡大を可能とし、これと蛍光顕微鏡とを組み合わせたものである。この装置では、通常の蛍光顕微鏡で観察可能である透過光像と蛍光像に加え、放射性同位元素の分布像の3つの画像を同時に取得することができるようになった。
さらに、よりシンプルな光路を持ち、撮像前の調整が容易な装置を開発した(図2-B左)。RI分布像と光学像の取得を同一光路に統合したことで、恣意性の無いスーパーインポーズが可能になり、また、RI像の取得にテーパーFOP(x5)よりも高倍率の対物レンズ(x20)が利用できるようになった。さらには、シンチレータープレートの自重によって試料とシンチレーターが密着するため、従来必要であった微調整が不要になり、RI添加から1分以内に観察を開始できるようになった。 この改良型ミクロシステムにより、解像度は核種にもよるが、おおよそ50 - 100μm程度を達成し、シロイヌナズナの根端数百μmという微小な領域における様々な元素の吸収動態を可視化することが可能になった(図2-B右)。
このように、本研究の結果、生きた植物体内での無機元素の動態がリアルタイムで可視化できる技術が開発された。この装置を用いることで、近年めざましく進展している分子生物学的な研究と、植物体内での実際の無機元素動態が結びつき、植物体全体の理解につながっていくことが期待される。
発表雑誌
- 雑誌名
- Philosophical Transactions of the Royal Society B
- 掲載日
- 2012年6月5日
- 論文タイトル
- Development of real-time radioisotope imaging systems for plant nutrient uptake studies
- 著者
- Satomi Kanno#, Masato Yamawaki#, Hiroki Ishibashi, Natsuko I. Kobayashi, Atsushi Hirose, Keitaro Tanoi, Laurent Nussaume and Tomoko M. Nakanishi*
#: contributed equally to this work
*: corresponding author - DOI番号
- doi:10.1098/rstb.2011.0229
- アブストラクト
- http://rstb.royalsocietypublishing.org/content/367/1595/1501.abstract
問い合わせ先
東京大学大学院農学生命科学研究科附属放射性同位元素施設/応用生命化学専攻放射線植物生理学研究室
教授 中西友子
E-mail: atomoko@mail.ecc.u-tokyo.ac.jp