プログラニュリンは脳内炎症反応を軽減する
-認知症原因遺伝子の一つであるプログラニュリンの役割を解明-
- 発表者
-
田中良法 (東京大学大学院農学生命科学研究科獣医学専攻 博士課程、日本学術振興会 特別研究員)
松脇貴志 (東京大学大学院農学生命科学研究科獣医学専攻 助教)
山内啓太郎 (東京大学大学院農学生命科学研究科獣医学専攻 准教授)
西原眞杉(東京大学大学院農学生命科学研究科獣医学専攻 教授)
発表のポイント
- 脳傷害部位に集積する活性化ミクログリア(注1)は、プログラニュリンを発現する。
- プログラニュリン欠損マウスでは活性化ミクログリアの集積が亢進し、過剰な酸化ストレスや血管新生が起こる。
- プログラニュリンはミクログリアの過剰な活性化を抑制し、脳傷害時の炎症反応を軽減する。
発表概要
東京大学大学院農学生命科学研究科獣医学専攻の田中良法特別研究員、西原眞杉教授らの研究グループは、マウスを用いた実験的脳傷害モデルによりプログラニュリンの炎症反応における役割を調べました。プログラニュリンは、近年、人ではその遺伝子変異が前頭側頭葉変性症(注2)等の神経変性疾患の原因となることが明らかとなり、認知症の発症との関連が着目されているタンパク質です。今回の研究により、プログラニュリンは脳傷害部位に集積する活性化ミクログリアに発現し、ミクログリア自身の過剰な活性化を抑制して炎症反応を軽減することが明らかになりました。プログラニュリンの持つこのような神経保護作用が、神経変性の抑制にも関連している可能性が考えられます。
発表内容
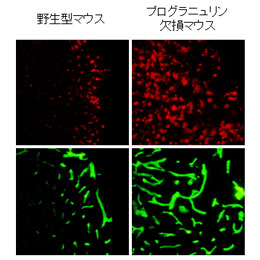
実験的脳傷害モデルにおけるCD68陽性の活性化ミクログリア(上)とラミニン(下)の免疫染色像。野生型マウス(左)と比べてプログラニュリン欠損マウス(右)ではミクログリアの過剰な活性化が起こるとともに、血管新生などの炎症反応が亢進している。 (拡大画像↗)
プログラニュリンは細胞の増殖や腫瘍の形成、創傷の治癒などに関与することが知られているタンパク質です。西原教授らの研究グループは、プログラニュリンの脳における発現が性ホルモンであるエストロゲンにより促進され、新生子の脳の性分化や成熟動物における神経新生に関与することを見出してきました。近年、プログラニュリン遺伝子の変異によるハプロ不全(注3)が人の認知症の一種である前頭側頭葉変性症の一因であることが報告され、またアルツハイマー病や筋萎縮性側索硬化症等の神経変性疾患の発症リスクを高めることも示唆されています。さらに最近、変異型プログラニュリン遺伝子のホモ接合により神経セロイドリポフスチン症が発症することも報告されました。これらのことは、プログラニュリンが神経変性を防ぐ作用、すなわち神経保護作用をもつことを示唆していますが、その仕組みは明らかになっていません。
今回、本研究グループはマウスの大脳皮質にステンレス針を刺入するという実験的な脳傷害モデルを用いて、その後の回復過程を調べました。その結果、コントロールの野生型マウスでは傷害後CD68を発現する活性化ミクログリアが増え、このミクログリアがプログラニュリンを発現していることが分かりました。本研究グループが作成したプログラニュリンの遺伝子を欠損するマウスを用いて同様の実験を行うと、野生型マウスよりもCD68を発現する活性化ミクログリアが傷害部位により多く集積するとともに、酸化ストレスの指標となるカルボニル化タンパク質の蓄積や血管新生の指標となるラミニンの免疫反応性が増大していることが明らかとなりました(図)。さらに、プログラニュリン欠損マウスではミクログリアの作用発現に関与するサイトカインであるTGFβ1の産生が上昇するとともに、アストロサイトにおいてTGFβ1の細胞内情報伝達を仲介するSmad3のリン酸化も亢進していました。
以上の結果より、脳に傷害が起こったときに傷害部位に集まる活性化ミクログリアでプログラニュリンが産生され、このプログラニュリンがミクログリア自身の過剰な活性化やTGFβ1シグナルを抑制することにより、酸化ストレスや血管のリモデリング、アストログリオーシス等の炎症反応を制御していることが示唆されました。プログラニュリンはこのような炎症抑制作用を通して神経保護作用を発揮していることが明らかとなり、またプログラニュリンのもつこのような神経保護作用が神経変性疾患を抑制する一つの機序となっていることが考えられました。
なお、本研究は日本学術振興会の科学研究費補助金の支援を受けて行われました。
発表雑誌
- 雑誌名
- 「Neuroscience」(オンライン版:2012年12月28日掲載)
- 論文タイトル
- Exacerbated Inflammatory Responses Related to Activated Microglia after Traumatic Brain Injury in Progranulin-Deficient Mice
- 著者
- Yoshinori Tanaka, Takashi Matsuwaki, Keitaro Yamanouchi, and Masugi Nishihara
- DOI番号
- 10.1016/j.neuroscience.2012.11.032
- アブストラクト
- http://www.sciencedirect.com/science/article/pii/S0306452212011438
問い合わせ先
東京大学大学院農学生命科学研究科 獣医学専攻 獣医生理学研究室
教授 西原眞杉
Tel: 03-5841-5386
Fax: 03-5841-8017
E-mail: amnishi@mail.ecc.u-tokyo.ac.jp
用語解説
- (注1) ミクログリア
- グリア細胞の一種で、感染や神経組織の損傷が起こると活性化してCD68等のタンパク質を発現し、炎症反応等を誘起して脳内における病変の修復を担う。
- (注2) 前頭側頭葉変性症
- 大脳の前頭葉と側頭葉に限局した萎縮が見られる神経変性疾患。認知症の一種で、記憶障害は軽度であるが意欲低下や攻撃性向の増大などの人格変化を示すことが知られている。
- (注3) ハプロ不全
- 対立遺伝子の片方に変異が起こり(ヘテロ接合)、その遺伝子によりコードされるタンパク質の量が減少するために病態が発現すること。