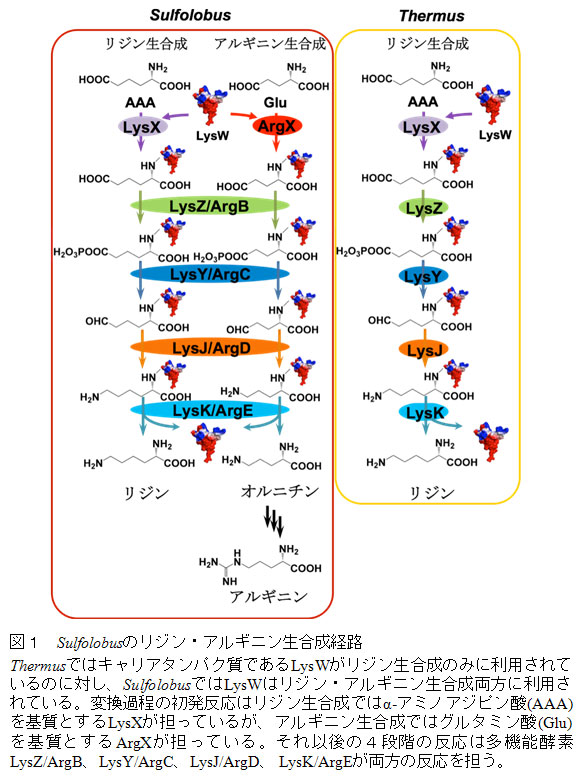
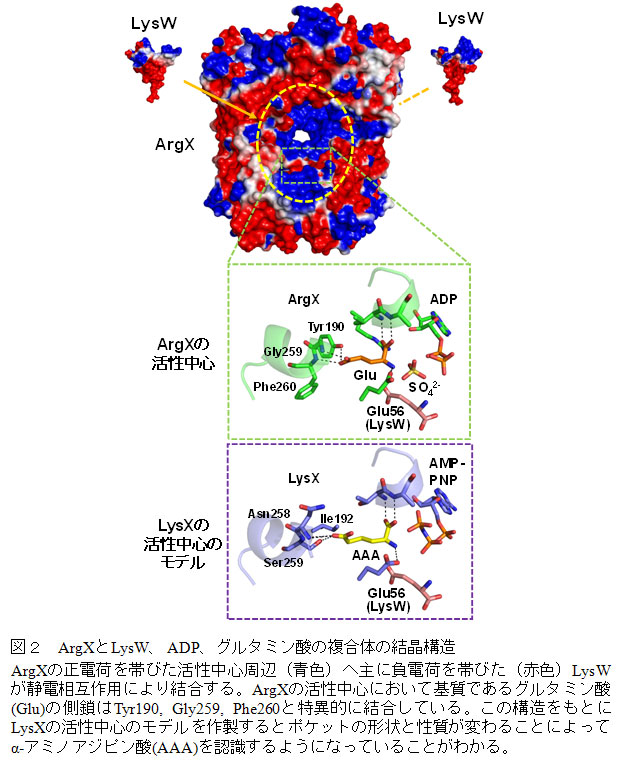
Sulfolobus属古細菌においてリジンとアルギニンは共通のキャリアタンパク質を用いて生合成される
- 発表者
-
大内拓也 (東京大学生物生産工学研究センター/大学院農学生命科学研究科応用生命工学専攻修士課程;現日本ユニシス)
富田武郎 (東京大学生物生産工学研究センター助教)
堀江 暁 (東京大学生物生産工学研究センター/大学院農学生命科学研究科応用生命工学専攻修士課程;現キリンホールディングス)
吉田彩子 (東京大学生物生産工学研究センター特任助教)
高橋賢人 (東京大学生物生産工学研究センター/大学院農学生命科学研究科応用生命工学専攻修士課程)
西田洋巳 (東京大学大学院農学生命科学研究科特任准教授)
Kerstin Lassak (Max Planck Institute for Terrestrial Microbiology)
高ひかり (順天堂大学医学部助教)
峯木礼子 (順天堂大学医学部助教)
藤村 務 (順天堂大学医学部准教授)
古園さおり (東京大学生物生産工学研究センター特任准教授)
西山千春 (順天堂大学医学部准教授)
増井良治 (大阪大学大学院理学研究科准教授)
倉光成紀 (大阪大学大学院理学研究科教授)
Sonja-Verena Albers (Max Planck Institute for Terrestrial Microbiology)
葛山智久 (東京大学生物生産工学研究センター准教授)
西山 真 (東京大学生物生産工学研究センター教授)
発表概要
古細菌であるSulfolobus acidocaldariusにおいてリジン生合成経路とアルギニン生合成経路の一部が共通のキャリアタンパク質と酵素群を用いて行われていることが明らかになった。さらに、アルギニン生合成経路の初発段階を担う酵素ArgXとキャリアタンパク質LysWおよび基質であるグルタミン酸の複合体の結晶構造を決定し、キャリアタンパク質が酵素に認識されている様子とArgXがグルタミン酸を特異的に認識していることが初めて明らかになった。この結果は、原始生命が少数の基質特異性が寛容な酵素群を用いてアミノ酸生合成を行っていたという代謝経路の進化仮説に関する実験証拠を提示したものといえる。
発表内容
リジン生合成には、アスパラギン酸を初発物質としてジアミノピメリン酸を経由する経路と2−オキソグルタル酸を初発物質としてα-アミノアジピン酸(AAA)を経由する経路の2つが存在し、前者の経路は広く細菌や植物に分布している。東京大学生物生産工学研究センターの西山教授のグループは、高度好熱菌Thermus thermophilusが細菌でありながらAAAを経由してリジンを生合成することや、この生合成経路において生合成中間体の分子内環化を防ぐタンパク質(LysW)保護修飾が存在していること、さらにはLysWが各生合成酵素に効率よく認識されるためのキャリアタンパク質(注1)としてはたらくことを見出してきた(Nat. Chem. Biol. (2009): 2009/7/21プレスリリース参照)。今回、西山教授らは、順天堂大学医学部、大阪大学大学院理学研究科、Max Planck Institute for Terrestrial Microbiologyとの共同研究により、古細菌(注2)であるSulfolobus acidocaldariusが、LysWを共通のキャリアタンパク質として利用することで、リジンとアルギニンの両方を生合成していることを発見した(図1)。S. acidocaldariusでは、リジンおよびアルギニン生合成の初発反応を担う酵素であるLysXおよびArgXは、互いに類似したアミノ酸配列を有するものの、それぞれリジンおよびアルギニン生合成に特化した基質特異性を示す。興味深いことに、以後の4つの反応を担う酵素はリジンおよびアルギニン生合成中間体の両方を区別無く基質として認識することが明らかになった。さらに、同グループはSulfolobus tokodaii由来のArgXとLysW、ADP、グルタミン酸の複合体の結晶構造を決定し、キャリアタンパク質が静電相互作用を介してArgXによって認識されている様子を初めて明らかにした(図2)。また、ArgXのグルタミン酸の認識機構の解明や、ArgXとLysXの基質特異性を決定しているアミノ酸残基を同定することにも成功している。本成果は、原始生命体では数少ない未分化な酵素群が多数の役割を果たすことにより生命システムが成立していたこと、それらが機能分化、多様化を経て現在の複雑な生命へと進化したというパッチワーク仮説(注3)を支持する実質的なデータを提供したもので、生命の起源や進化を考える上での重要な知見を与えただけでなく、新規なアミノ酸代謝経路の発見や創生への基盤となることが期待される。
発表雑誌
- 雑誌名
- 「Nature Chemical Biology」(オンライン版2月24日, DOI: 10.1038/nchembio.1200)
- 論文タイトル
- Lysine and arginine biosyntheses mediated by a common carrier protein in Sulfolobus
- 著者
- Takuya Ouchi, Takeo Tomita, Akira Horie, Ayako Yoshida, Kento Takahashi, Hiromi Nishida, Kerstin Lassak, Hikari Taka, Reiko Mineki, Tsutomu Fujimura, Saori Kosono, Chiharu Nishiyama, Ryoji Masui, Seiki Kuramitsu, Sonja-Verena Albers, Tomohisa Kuzuyama & Makoto Nishiyama
問い合わせ先
東京大学生物生産工学研究センター 細胞機能工学部門
教授 西山 真
Tel: 03-5841-3074
Fax: 03-5841-8030
E-mail: umanis@mail.ecc.u-tokyo.ac.jp
用語解説
(注1)キャリアタンパク質:目的のものを効率よく運ぶための輸送タンパク質。
(注2)古細菌(アーキア):真正細菌(バクテリア)、真核生物(ユーカリア)とともに生物の3ドメインを構成する。細胞膜にエーテル型脂質を利用していることが特徴的な生物群。真正細菌と類似した形態を持ちながら、DNAの複製やタンパク質合成系といった基幹システムの機構が真核生物と類似している。生物の進化系統において共通の起源に近い位置を占めると考えられている。
(注3)パッチワーク仮説:代謝経路は未分化で基質特異性が寛容な酵素をリクルートすることによってできたとする説。初期の生物はゲノムサイズが小さく、限られた数の遺伝子しかゲノムにコードすることが出来なかったものと推測されるが、基質特異性が寛容な酵素が化学的に類似した基質と反応することで多くの代謝が可能であり、こうした生物においても生命活動が可能であったと考えられる。