多能性幹細胞からオレキシン神経細胞の作出に成功
- 発表者
-
早川晃司 (東京大学大学院農学生命科学研究科 応用動物科学専攻 特任助教)
塩田邦郎 (東京大学大学院農学生命科学研究科 応用動物科学専攻 教授)
発表のポイント
- ◆どのような成果を出したのか
- 睡眠、食欲などの制御を司るオレキシン神経細胞をマウス多能性幹細胞から作りだすことに成功した。
- ◆新規性
- 世界中で創薬や再生医療を目的に、iPS細胞や胚性幹細胞(ES細胞)などの多能性幹細胞から様々な神経細胞が作り出されてきたが、オレキシン神経細胞の作出は世界初である。
- ◆社会的意義/将来の展望
- 食欲改善、睡眠障害、モチベーションの回復などの治療薬の開発、再生医療への道が開けた。
発表概要
東京大学大学院農学生命科学研究科塩田邦郎らの研究グループは、多能性幹細胞(マウスES細胞、およびヒトiPS細胞)からオレキシン神経細胞を作り出すことに世界で初めて成功した。これは、様々な疾病や老化に伴う睡眠障害や食欲減退、さらには過眠症(ナルコレプシー)の治療を目指した再生医療や創薬研究に繋がる成果である。
発表内容
①研究の背景・先行研究における問題点
世界中で創薬や再生医療を目的に、iPS細胞や胚性幹細胞(ES細胞)などの多能性幹細胞から、様々な神経細胞が作り出されてきた。オレキシンは睡眠・覚醒および摂食行動の制御をコントロールしている神経ペプチドであり、様々な疾病や老化に伴いオレキシン神経細胞が減少することが知られている。オレキシン神経細胞がどのようにできるのかは不明で、これまで作出に成功していなかった。今回、塩田邦郎らの研究グループは、マウスのES細胞から分化誘導によりオレキシン神経細胞を作り出すことに成功した。また、その成果をヒトiPS細胞にも応用してヒトiPS細胞からもオレキシン細胞を作れることが分かった。
②研究内容(具体的な手法など詳細)
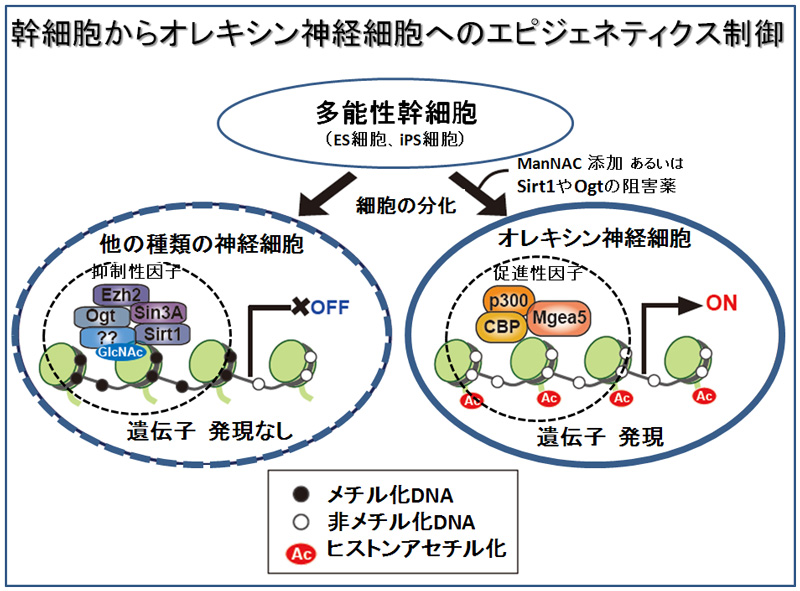
実験では、マウスES細胞から神経細胞を作る際に、糖代謝中間体を加え様子を見た。その結果、中間体の1つであるN-アセチルマンノサミン(ManNAc)を添加するとオレキシンを作る遺伝子(Hcrt遺伝子)が発現することが明らかになった。従来の培養方法で作った神経細胞では、Hcrt遺伝子の制御部分には様々な抑制性の因子(ヒストン脱アセチル化酵素Sit1、および糖転移酵素Ogtなど)が結合しており、その結果、DNAがメチル化(注1)され遺伝子を利用できない―いわゆる眠った状況にある―ことがわかった(図)。一方、ManNAcを加えるとDNAの脱メチル化が進み、ヒストンのアセチル化(注2)を促進することで、Hcrt遺伝子が利用できる状況が出来上がった。この時、Hcrt遺伝子の制御部位に結合していた抑制性因子(SirtとOgt等)は促進性因子(Mgea5等)に置き換わり、ヒストンがアセチル化されていた。このようにして作られた神経細胞は脳内のオレキシン神経細胞で見られる他のマーカー遺伝子も発現しており、またオレキシンを分泌する能力もあり、その分泌は他の神経ペプチドであるレプチンやグレリンなどに反応することも明らかになったため、この神経細胞はオレキシン神経細胞であることが確認された。
細胞の分化にはエピジェネティクス(注3)状況を変えることが必要になるが、ManNAcにはエピジェネティクス機構に働きかけオレキシン神経細胞を誘導する働きがあることが明らかになった。
③社会的意義・今後の予定など
オレキシン神経細胞の作出に成功し、同神経細胞への分化のメカニズムも明らかになったため、食欲改善、睡眠障害、モチベーションの回復などの治療薬の開発、再生医療への道が開けた。
本研究は独立行政法人医薬基盤研究所の先駆的医薬品・医療機器研究発掘支援事業の資金により行われた。
発表雑誌
- 雑誌名
- 「Journal of Biological Chemistry」 (American Society for Biochemistry and Molecular Biologyの機関誌) 2013年4月26日(米国時間)オンライン版
- 論文タイトル
- Epigenetic switching by the metabolism-sensing factors in the generation of orexin neurons from mouse embryonic stem cells
- 著者
- Koji Hayakawa, Mitsuko Hirosawa, Yasuyuki Tabei, Daisuke Arai, Satoshi Tanaka, Noboru Murakami, Shintaro Yagi, and Kunio Shiota
- DOI番号
- doi/10.1074/jbc.M113.455899
- アブストラクト
- http://www.jbc.org/content/early/2013/04/26/jbc.M113.455899.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 応用動物科学専攻 細胞生化学研究室
教授 塩田邦郎
Tel: 03-5841-5472
Fax: 03-5841-8014 または 03-5841-8189
E-mail: ashiota@mail.ecc.u-tokyo.ac.jp
細胞生化学研究室: http://www.vm.a.u-tokyo.ac.jp/seika/
用語解説
- (注1) DNAのメチル化
- 哺乳類ではDNAを構成するアデニン(A)、グアニン(G)、シトシン(C)、チミン(T)の4種類の塩基のうち、主にCG配列のC にのみ酵素によってメチル基が付加される。DNAがメチル化された領域は遺伝子が存在していても利用できない状況になる。DNAはヒストンという特殊なたんぱく質に巻き付いた形で核の中におさめられているが、DNAがメチル化されると、構造が凝縮し遺伝子が利用できなくなるためである。
- (注2) ヒストンのアセチル化
- ヒストンは様々な分子に修飾されている。ヒストンのアセチル化はその1つである。ヒストンがアセチル化されると遺伝子が使える状態(活性化)を作りだす。それに対して、ヒストンが他の分子で修飾されると活性化と休眠状況の両方を作り出す。
- (注3) エピジェネティクス
- エピジェネティクス(epigenetics)とは「DNAの塩基配列の変化を伴わずに細胞分裂後も伝達される遺伝子機能の変化について探求する学問領域」を意味する。DNAメチル化とヒストン修飾がエピジェネティクス制御の中心である。DNAメチル化とヒストン修飾の組み合わせで、DNAとヒストンが巻き付いた(クロマチン)構造が変化し、細胞の固有の遺伝子発現パターンが固定化される。同じゲノムを持ちながら種類が異なる細胞の間でなぜ遺伝子発現(つまり形質)が違うのかを研究するのがエピジェネティクスである。