認知症原因遺伝子の一つであるプログラニュリンは活性化ミクログリアにおけるリソソーム生合成を制御する
- 発表者
-
田中良法 (東京大学大学院農学生命科学研究科獣医学専攻 博士課程、日本学術振興会 特別研究員)
松脇貴志 (東京大学大学院農学生命科学研究科獣医学専攻 助教)
山内啓太郎 (東京大学大学院農学生命科学研究科獣医学専攻 准教授)
西原眞杉 (東京大学大学院農学生命科学研究科獣医学専攻 教授)
発表のポイント
- プログラニュリンはリソソームに局在し、活性化ミクログリアにおけるリソソーム生合成を抑制する。
- プログラニュリン欠損マウスではmTORC1(注1)の活性が低下し、転写因子TFEBの核移行が亢進する。
- プログラニュリンはリソソームに関連する細胞傷害性因子の発現を抑制し、脳傷害時の神経損傷を軽減する。
発表概要
東京大学大学院農学生命科学研究科獣医学専攻の田中良法特別研究員、西原眞杉教授らの研究グループは、マウスを用いた実験的脳傷害モデルによりプログラニュリンのリソソーム生合成における役割を調べました。プログラニュリンは人ではその遺伝子変異が前頭側頭葉変性症(注2)等の神経変性疾患の原因となることが明らかとなり、認知症の発症との関連が着目されているタンパク質です。今回の研究により、プログラニュリンは脳傷害部位に集積する活性化ミクログリアにおける過剰なリソソーム生合成をmTORC1の活性化を介して抑制することが明らかになりました。また、プログラニュリンは脳傷害時の神経損傷を軽減することが明らかとなり、それにはリソソーム病で発現が増加することが知られている細胞傷害性因子の関与が考えられました。プログラニュリンのもつリソソーム生合成抑制作用が、神経変性の抑制にも関連している可能性が考えられます。
発表内容
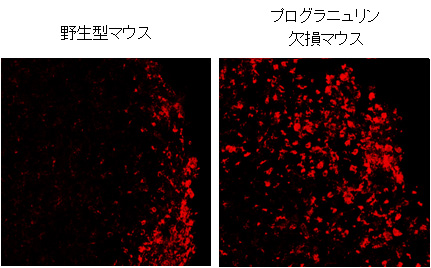
図1.実験的脳傷害モデルにおけるLamp1(リソソームのマーカー)の免疫染色像。野生型マウス(左)と比べてプログラニュリン欠損マウス(右)ではリソソームの生合成が亢進している。 (拡大画像↗)
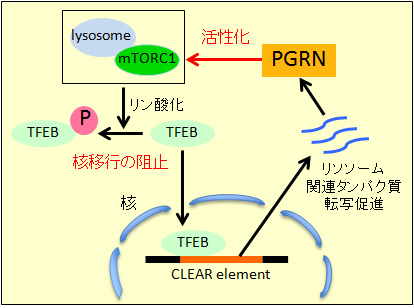
図2.プログラニュリン(PGRN)のリソソーム生合成における役割。プログラニュリンはリソソームに局在するmTORC1を活性化し、転写因子TFEBをリン酸化することによりその核移行を阻止し、リソソーム関連タンパク質の過剰な生合成を抑制する。 (拡大画像↗)
プログラニュリンは細胞の増殖や腫瘍の形成、神経変性の抑制などに関与することが知られているタンパク質です。西原教授らの研究グループは、プログラニュリンの脳における発現が性ホルモンであるエストロゲンにより促進され、新生子の脳の性分化や成熟動物における神経新生に関与することを見出してきました。また、最近ではプログラニュリンの発現が脳傷害後の活性化ミクログリアで増加し、CD68の過剰な発現を抑制することを明らかにしました。CD68はリソソーム関連タンパク質ファミリーに属するタンパク質で、このファミリーに属するタンパク質群の発現の多くは転写因子TFEBが細胞質から核に移行し、DNAのTFEB結合領域であるCLEAR配列に結合することにより制御されていることが明らかとなっています。TFEBはリソソームに局在する活性化したmTORC1によるリン酸化によって細胞質における局在が維持されていますが、mTORC1の活性が低下するとTFEBは脱リン酸化し、核に移行することが知られています。近年、変異型PGRN遺伝子のホモ接合では神経セロイドリポフスチン症(注3)を発症するなどリソソームにおけるプログラニュリンの役割が示唆されていますが、プログラニュリンとリソソーム生合成の関係は明らかになっていません。
今回、本研究グループはマウスの大脳皮質にステンレス針を刺入するという実験的な脳傷害モデルを用いて、脳傷害後の活性化ミクログリアでのリソソーム生合成におけるプログラニュリンの役割を調べました。その結果、本研究グループが作成したプログラニュリン遺伝子を欠損するマウスでは、野生型マウスよりもリソソームのマーカーであるLamp1タンパク質の発現が活性化ミクログリアにおいて増加していました(図1)。傷害部位のリソソーム関連タンパク質群の遺伝子発現量もプログラニュリン欠損マウスで増加しており、プログラニュリンの欠損によってミクログリアにおけるリソソーム生合成が促進されることが示唆されました。そこで、リソソーム生合成を制御する経路とプログラニュリンの関連を調べたところ、核に転写因子TFEBが局在する活性化ミクログリアの数はプログラニュリン欠損マウスで野生型マウスと比較して増加していました。さらに、転写因子TFEBの核移行を制御するmTORC1の活性を比較したところ、プログラニュリン欠損マウスではmTORC1の活性が野生型マウスと比較して低下していました。また、プログラニュリン遺伝子のプロモーター領域にはTFEB結合領域であるCLEAR配列が存在すること、脳傷害部位ではプログラニュリンの多くがリソソームに局在することが明らかとなりました。一方で、プログラニュリン欠損マウスでは野生型マウスと比較してリソソーム病で発現が増加することが知られている細胞傷害性因子の遺伝子発現も増加していました。さらに、脳傷害後の神経損傷を比較したところ、プログラニュリン欠損マウスでは野生型マウスと比較して神経損傷が亢進していました。
以上の結果から、①リソソームに局在するプログラニュリンはmTORC1を活性化することでTFEBの核移行を抑制し、脳傷害後の活性化ミクログリアにおけるリソソームの過剰な生合成を抑制すること、②リソソーム生合成時にはプログラニュリンの発現がさらに増強されること、③プログラニュリンはリソソーム生合成に関連して発現増加する細胞傷害性因子の発現を抑制することで脳傷害後の神経損傷を軽減していることが示唆されました(図2)。プログラニュリンのもつリソソーム生合成抑制作用が神経変性疾患の発症を抑制する一つの機序となっていることが考えられました。
なお、本研究は日本学術振興会科学研究費補助金の支援を受けて行われました。
発表雑誌
- 雑誌名
- 「Neuroscience」(オンライン版:2013年7月2日掲載)
- 論文タイトル
- Increased Lysosomal Biogenesis in Activated Microglia and Exacerbated Neuronal Damage after Traumatic Brain Injury in Progranulin-Deficient Mice
- 著者
- Yoshinori Tanaka, Takashi Matsuwaki, Keitaro Yamanouchi, and Masugi Nishihara
- DOI番号
- 10.1016/j.neuroscience.2013.06.049
- アブストラクト
- http://www.sciencedirect.com/science/article/pii/S0306452213005551
問い合わせ先
東京大学大学院農学生命科学研究科 獣医学専攻 獣医生理学研究室
教授 西原眞杉
Tel: 03-5841-5386
Fax: 03-5841-8017
E-mail: amnishi@mail.ecc.u-tokyo.ac.jp
用語解説
- (注1) mTORC1
- 成長因子や栄養・エネルギー状態など細胞内外の環境情報を統合して細胞内情報伝達に関わるタンパク質キナーゼ複合体。活性化したmTORC1はリソソームに局在し、リン酸化によって転写因子TFEBの核移行を抑制する。
- (注2) 前頭側頭葉変性症
- 大脳の前頭葉と側頭葉に限局した萎縮が見られる神経変性疾患。認知症の一種で、記憶障害は軽度であるが意欲低下や攻撃性向の増大などの人格変化を示すことが知られている。
- (注3) 神経セロイドリポフスチン症
- リソソームによる分解処理機構の破綻に起因するリソソーム病の一種。神経細胞を中心にセロイドリポフスチンを含むリソソームが蓄積する。