運動による脂質代謝改善効果の分子機構を解明
- エネルギーセンサータンパク質AMPKの骨格筋における新たな役割 -
- 発表者
-
佐々木 崇(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士課程)
中田 理恵子(奈良女子大学生活環境学部 講師)
井上 裕康(奈良女子大学生活環境学部 教授)
清水 誠(東京大学大学院農学生命科学研究科 応用生命化学専攻 助教)
井上 順(東京大学大学院農学生命科学研究科 応用生命化学専攻 准教授)
佐藤 隆一郎(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
発表のポイント
◆運動による代謝改善効果の分子機構は、骨格筋においてエネルギーセンサータンパク質AMPK(注1)を活性化することから始まり、PPARγ1(注2)の上昇を介してリポタンパク質リパーゼLPL(注3)の発現が亢進するという経路を、初めて明らかにしました。
◆エネルギー代謝を包括的に支配するAMPKとPPARγ1との骨格筋における新たな接点を明らかにしました。
◆AMPKによる脂質代謝改善機構の詳細を分子レベルで明らかにすることで、メタボリックシンドローム予防へ向けた新たな道筋を示しました。AMPKは運動のみならず、食品成分によっても活性化されることから、運動機能の一部を食品機能で代替することも可能となります。本研究は、十分な運動を実施することが不可能な高齢者の増加が見込まれる高齢社会において、高齢者の健康維持に食の機能を活用する可能性を提示しています。
発表概要
東京大学大学院農学生命科学研究科 佐藤隆一郎教授らの研究グループは、運動による脂質代謝改善に関わる新たな分子機構を明らかにしました。
メタボリックシンドロームの発症には、運動習慣の有無が大きく影響することが知られています。特に運動による脂質代謝改善においては、骨格筋でLPL発現が上昇する事が重要とされています。LPLは運動により発現上昇した後に血中に分泌され、キロミクロンやVLDL等のリポタンパク質中に含まれるトリグリセリドを分解します。その後、分解産物である脂肪酸を骨格筋細胞が積極的に取り込むことで脂質代謝が改善します。しかし運動後の骨格筋でなぜLPL発現が上昇するのか、分子レベルでの明確な答えは出ていませんでした。
近年、運動による代謝改善効果を担う因子としてAMPK(AMP-activated protein kinase)が注目されています。AMPKには運動によって生じる細胞内エネルギー枯渇を感知し、その回復に努める機能分子です。本研究では、AMPKが核内受容体PPAR(peroxisome proliferator-activated receptor)γ1の発現亢進を介してLPLの発現上昇を誘導することを新たに見出し、更にAMPKによるPPARγ1の発現亢進の一部は、mRNAの安定化と言う一風変わった機構により調節されていることを明らかにしました(図1)。
この結果は運動による脂質代謝改善機構の一端を明らかにするものであり、新たなメタボリックシンドローム予防法の確立に繋がることが期待されます。
発表内容
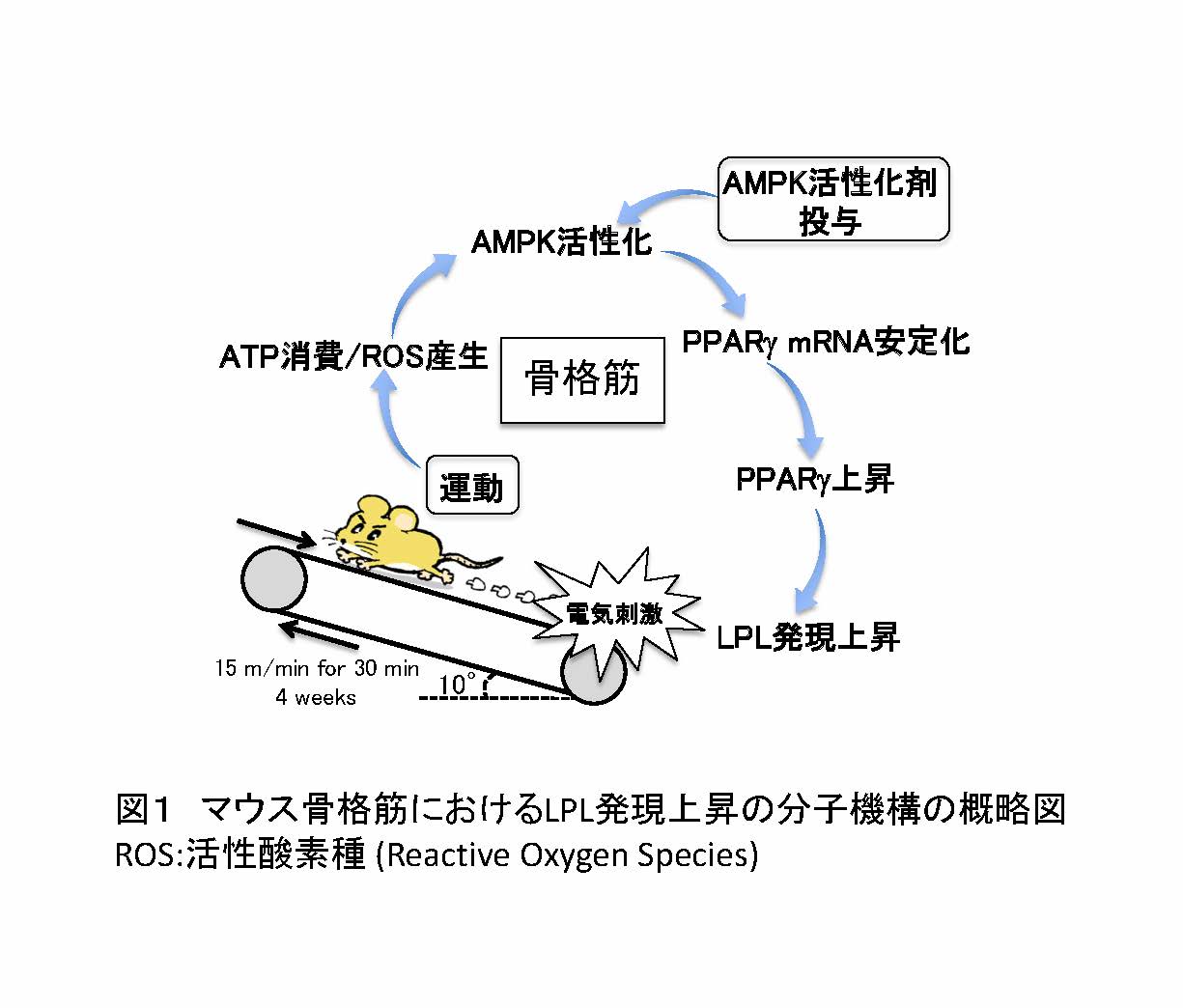
図1 マウス骨格筋におけるLPL発現上昇の分子機構の概略図
ROS:活性酸素種 (Reactive Oxygen Species)(拡大画像↗)
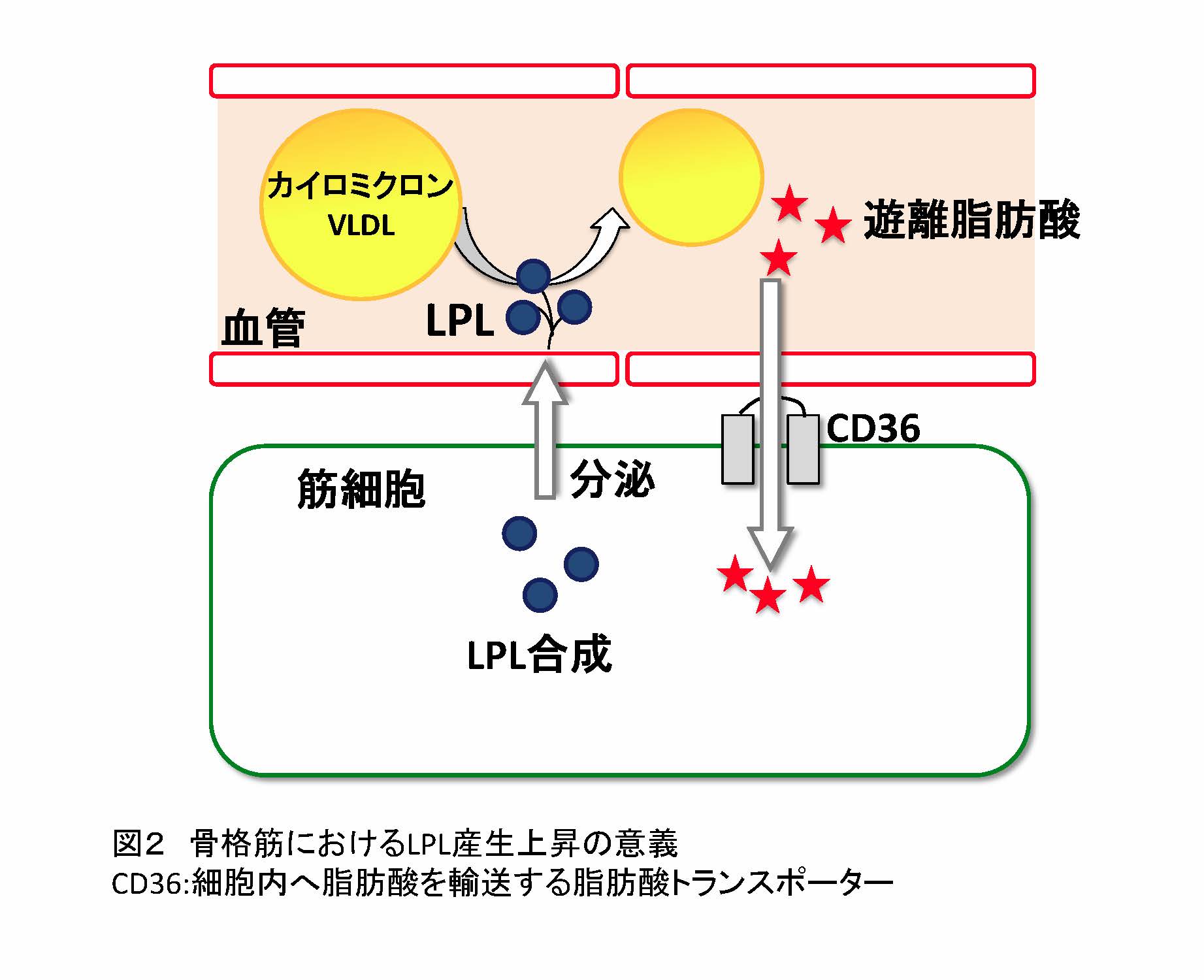
図2 骨格筋におけるLPL産生上昇の意義
CD36:細胞内へ脂肪酸を輸送する脂肪酸トランスポーター(拡大画像↗)
近年、先進国を中心にメタボリックシンドロームが深刻な社会問題となっており、国民の健康寿命の延伸や、年々増大する医療費を削減するためにも、その対策が急務となっています。メタボリックシンドロームに伴う生活習慣病は、その名の通り生活習慣を見直すことで大部分が改善可能です。特に運動による脂質代謝の改善に関しては、骨格筋におけるLPLの活性化がその一端を担うと考えられていますが、運動により骨格筋においてLPL発現が上昇するメカニズムに関して、分子レベルでの明確な答えは出ていませんでした。
今回、斜度10°のトレッドミルを用い、マウスに対して毎分15mの速度で30分の走行運動を週5回、4週間にわたり負荷しました。その結果、非運動群のマウスに比べ、運動群マウスでは骨格筋におけるPPARγ1およびLPLのmRNA量が有意に上昇することを認めました。核内受容体であるPPARファミリーはα、β/δ、γの3種類のサブタイプが存在し、様々なエネルギー代謝に関わることが知られています。骨格筋においてはPPARファミリー中のPPARα、およびPPARβ/δが脂肪酸代謝関連遺伝子の発現を調節することが知られていました。一方、PPARγは脂肪細胞において重要な働きをしていますが、骨格筋における発現量は脂肪組織の10%以下であることから、その機能については不明な点が多く残されていました。そこで筋細胞におけるPPARγ1の機能を明らかにするため、培養筋管細胞C2C12にPPARγ1を過剰発現させ、種々の遺伝子発現応答を追跡しました。その結果、LPL mRNAおよびタンパク質の突出した上昇が確認されたことから、PPARγ1がLPL発現を調節する因子であることが明らかになりました。更に研究グループは、運動時にPPARγ1発現を上昇させる上流因子の同定を試みました。ここで着目した因子が、運動により活性化するエネルギーセンサータンパク質AMPKです。培養筋管細胞C2C12をAMPK活性化剤であるAICARやメトフォルミン、AMPKを間接的に活性化するH2O2を含む培地で培養すると、PPARγ1 mRNAならびにタンパク質の上昇が確認されました。この上昇は、同時にAMPK阻害剤を培地に加えると解除されたことから、AMPK活性化によりPPARγ1 mRNAが上昇することが明らかになりました。さらに、マウスに対し3日間AICARを投与した所、やはり骨格筋においてPPARγ1、LPL mRNAの有意な上昇が確認されました。以上の結果より、運動→AMPK活性化→PPARγ1増加→LPL上昇の分子機構が明らかにされました。運動刺激により骨格筋はLPL分泌を上昇させ、エネルギー源となる遊離脂肪酸を細胞内に積極的に取り込む適応をしていると考えることができます。
続いて、AMPK活性化によるPPARγ1発現上昇の分子機構を解析しました。その結果興味深いことに、PPARγ1 mRNAは通常およそ4時間の半減期で分解するのに対し、AMPKを活性化することで半減期が12時間程度まで延伸することが明らかになりました。ここで見られたmRNA安定化は、AMPK阻害剤により抑制されました。PPARγ1 mRNAの3'非翻訳領域には、半減期の短いmRNAに特徴的なAU-rich配列が5カ所存在し、いずれもヒト、マウス、ラットで保存されています。この結果は、AMPKがAU-rich配列を介したmRNAの分解機構を抑制する作用を持つことを示唆しています。
以上の解析により、骨格筋における、運動→AMPK活性化→PPARγ1増加→LPL上昇の分子機構が明らかとなりました。AMPKは、運動のみならず食品に含まれる種々のポリフェノール等によっても活性化されることが知られています。来るべき高齢社会において、運動が十分にできない高齢者の健康維持に、AMPK活性化能を持つ食品が活用されることが期待されます。
発表雑誌
- 雑誌名
- American Journal of Physiology Endocrinology and Metabolism
- 論文タイトル
- The role of AMPK and PPARγ1 in exercise-induced lipoprotein lipase in skeletal muscle.
- 著者
- Takashi Sasaki , Rieko Nakata , Hiroyasu Inoue , Makoto Shimizu , Jun Inoue, Ryuichiro Sato
- DOI番号
- 10.1152/ajpendo.00691.2013
- アブストラクト
- http://ajpendo.physiology.org/content/early/2014/03/13/ajpendo.00691.2013
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学研究室
教授 佐藤隆一郎
Tel:03-5841-5136
Fax:03-5841-8029
研究室URL:http://park.itc.u-tokyo.ac.jp/food-biochem/
用語解説
- 注1 AMPK (エネルギーセンサータンパク質、AMP-activated protein kinase)
- α、β、γの3つのサブユニットから構成される三量体タンパク質。細胞内のエネルギー枯渇(AMP/ATP比の上昇)を感知し、リン酸化を受けることにより活性型となり、細胞内へのグルコース取り込みやβ酸化を促進します。糖尿病治療の重要なターゲットであり、経口糖尿病治療薬であるメトフォルミンの効果の一部は、AMPKの活性化によるものと考えられています。
- 注2 PPAR (peroxisome proliferator-activated receptor) γ
- 脂溶性リガンドを結合して活性化される核内受容体の1種であるPPARγは脂肪細胞に高発現しており、脂肪細胞分化のマスターレギュレーターとして働くことがよく知られています。PPARγには複数のアイソフォームが存在しており、γ2が主に脂肪組織で発現するのに対し、γ1は骨格筋を含む比較的幅広い組織に発現しています。骨格筋におけるPPARγの発現量は脂肪組織の5 -10%程度とされており、そのためか骨格筋におけるPPARγの機能は十分に解析が進んでいるとは言い難い状況でした。
- 注3 LPL (リポタンパク質リパーゼ、Lipoprotein lipase)
- LPLは骨格筋や脂肪組織で発現量が高く、これらの組織を中心に合成・分泌された後、付近の毛細血管壁に係留された形で存在します。LPLは血中のキロミクロンやVLDLに含まれるトリグリセリドを加水分解し、脂肪酸を遊離させた後、CD36などの脂肪酸トランスポーターを介して細胞内へ脂肪酸を取り込むと考えられています(図2)。遺伝的に糖尿病になりやすい家系のヒトでは、骨格筋におけるLPL発現量が低いことが報告されています。