シロアリ腸内に共生する原生生物由来の新規なマンナン分解酵素の立体構造を解明
- 発表者
-
塚越 光(東京大学大学院農学生命科学研究科 応用生命工学専攻 修士課程(当時))
中村 彰彦(東京大学大学院農学生命科学研究科 生物材料科学専攻 日本学術振興会特別研究員)
石田 卓也(東京大学大学院農学生命科学研究科 生物材料科学専攻 特任助教)
東原 幸起(東京大学大学院農学生命科学研究科 応用生命工学専攻 学部学生(当時))
小田切 正人(独立行政法人理化学研究所 環境資源科学研究センター バイオマス工学連携部門 バイオマス研究基盤チーム 研究員)
守屋 繁春(独立行政法人理化学研究所 環境資源科学研究センター バイオマス工学連携部門 バイオマス研究基盤チーム 専任研究員 横浜市立大学大学院先端医科学研究科 客員准教授)
鮫島 正浩(東京大学大学院農学生命科学研究科 生物材料科学専攻 教授)
五十嵐 圭日子(東京大学大学院農学生命科学研究科 生物材料科学専攻 准教授)
伏信 進矢(東京大学大学院農学生命科学研究科 応用生命工学専攻 教授)
北本 勝ひこ(東京大学大学院農学生命科学研究科 応用生命工学専攻 教授)
有岡 学(東京大学大学院農学生命科学研究科 応用生命工学専攻 准教授)
発表のポイント
◆ヤマトシロアリ(注1)の腸内に共生する原生生物が持つ、新規なマンナン分解酵素の立体構造を解明しました。
◆本酵素は、直鎖マンナンよりもグルコース等を含むグルコマンナンに対してより高い分解活性を示しますが、それが活性中心近傍における緩やかな基質認識によるものであることがわかりました。
◆本酵素はシロアリが持つ高い木質分解・資化活性に寄与しているものと考えられ、今後その利用による非可食性バイオマス分解の高効率化が期待されます。
発表概要
マンナナーゼは植物細胞壁中のヘミセルロースの一種であるマンナンを分解するヘミセルラーゼであり、マンナン主鎖のマンノース間またはマンノース・グルコース間のβ-1,4結合をランダムに加水分解するエンド型酵素です。ヤマトシロアリReticulitermes speratusの腸内に共生する原生生物に由来するマンナナーゼは糖質加水分解酵素(Glycoside hydrolase: GH)ファミリーのGH26に属しますが、同ファミリーではこれまで原生生物由来の酵素に関する報告はありませんでした。木質系バイオマス分解への応用においてマンナナーゼは特に針葉樹材に多く含まれるマンナンの分解・除去に効果的であると考えられます。
本研究では、生化学的・構造生物学的手法を用いてヤマトシロアリ腸内原生生物由来のマンナナーゼRsMan26Cの機能解析を行いました。
発表内容
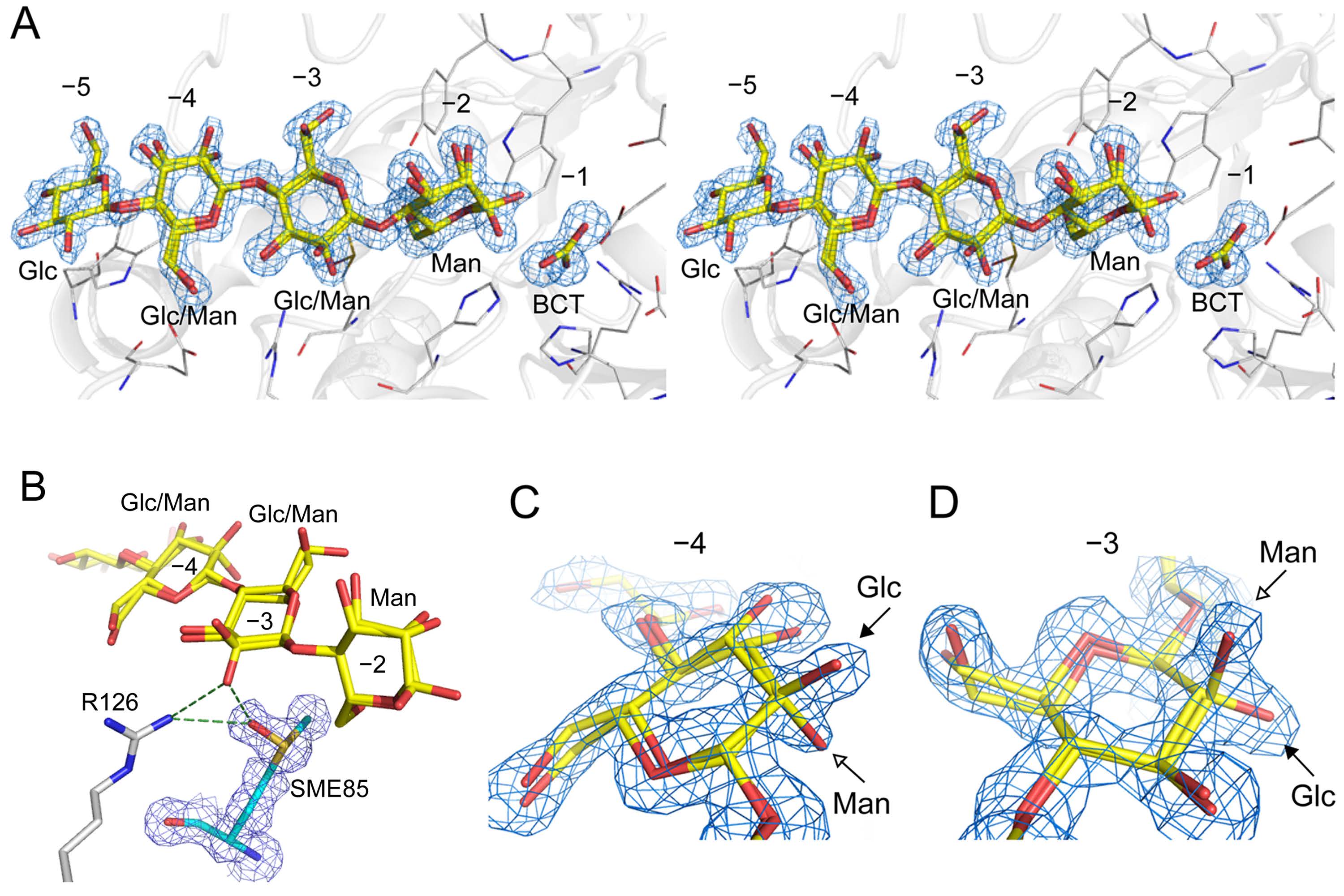
RsMan26Cとグルコマンナン部分加水分解物との共結晶構造のステレオ図(図A)。
サブサイト-2にマンノースが認められる一方、-5にはグルコースが、-3と-4にはマンノースとグルコースの両方が存在し、本酵素がグルコマンナンに対し高い活性を示す理由と考えられた(図C、D)。
サブサイト-3では、酸化されたメチオニン(SME85)とArg-126がグルコースを特異的に認識していることが示唆された(図B)。(拡大画像↗)
近年、木材等のセルロース系バイオマスに資源としての注目が集まっていますが、その利用にあたっては、セルロース・ヘミセルロース・リグニンから成る強固な植物細胞壁を、酵素によって分解するバイオ変換プロセスが重要と考えられます。木材等を主食とするシロアリは、多数の糖が結合した構造であるセルロース・ヘミセルロースの木質成分を資化する能力を持つ生物であり、その高度な木材分解システムの応用が期待されます。シロアリは家屋の建材に深刻な食害を与える害虫でもありますが、シロアリの木材分解システムにおいては、シロアリ自身の内在性酵素に加え、腸内に共生する原生生物が大きく寄与していることが知られています。建材として多く用いられる針葉樹材の主成分の一つが、マンナンと呼ばれるヘミセルロースの一種です。マンナンには基本構造のバリエーションがあり、マンノースのみがβ-1,4結合した直鎖マンナン、マンノースまたはグルコースがβ-1,4結合したグルコマンナン、ガラクトース側鎖の修飾がついたガラクトマンナン等が存在します。シロアリの木材分解系にはマンナンを分解する機能がありますが、シロアリ自身はマンナン分解酵素(マンナナーゼ)を持たないため、シロアリ腸内に共生する原生生物のみがマンナナーゼを有していると考えられます。マンナナーゼはマンナンまたはグルコマンナンのβ-1,4結合をランダムに加水分解する酵素として知られていますが、グルコースとマンノースがランダムに結合したグルコマンナンを、どのように認識あるいは許容しているのか、詳しいメカニズムは明らかではありませんでした。
今回筆者らは、ヤマトシロアリの腸内に共生する原生生物由来のGH26に属するマンナナーゼRsMan26Cの生化学的・構造学的解析を行うことで、この酵素がグルコマンナンをその活性中心近傍で認識・許容する機構を明らかにしました。
まず、マンナナーゼRsMan26Cの生化学的性質を明らかにするため、メタノール資化性酵母Pichia pastorisを宿主としてRsMan26Cの異種生産を行い、精製酵素を用いて酵素学的解析を行いました。その結果、RsMan26Cが4糖以上のマンノオリゴ糖、直鎖マンナン及び不溶性の結晶性マンナンをランダムに分解することがわかりました。また、グルコマンナンとガラクトマンナンに対しては、直鎖マンナンの2倍を超える活性を示しました。
このことから、RsMan26Cはその活性部位においてガラクトース側鎖を許容しやすく、またマンノースとグルコースの混ざったヘテロ多糖を基質として認識できる、緩やかな基質特異性を持つことが示唆されました。
次にRsMan26CのX線結晶構造解析(注2)を行ったところ、本来のネイティブ構造に加え、グルコマンナンの加水分解産物(グルコマンノオリゴ糖)との共結晶構造を得ることができました。RsMan26Cの全体構造(ネイティブ構造)は典型的な (β/α)8 TIMバレル(注3)で、他のGH26ファミリー同様に、活性中心残基のGlu-191、Glu-288、サブサイト-1においてマンノースを特異的に認識するHis-124、His-190、Trp-307などが保存されていました。一方、グルコマンノオリゴ糖との共結晶構造では、活性部位のサブサイト-5から-2にかけてグルコマンノオリゴ糖が結合していました。サブサイト-2にはマンノースのみが結合していたのに対して、サブサイト-4と-3にはマンノースとグルコースの両方が、サブサイト-5にはグルコースのみが結合していました。特にサブサイト-3では、Arg-126と、酸化されたメチオニン(SME85)がグルコースの特異的な認識にそれぞれ関与していることが示唆されました。
以上の結果から、RsMan26Cはサブサイト-5、-4、-3においてグルコースを許容または認識できることが示唆され、このことはRsMan26Cがグルコマンナンに対し高い活性を示す理由であると考えられました。
本研究により、シロアリ腸内に共生する原生生物の木材分解機構の一端が明らかになりました。今後、こうした知見がバイオマス利用系の構築に活用されていくことが期待されます。
発表雑誌
- 雑誌名
- 「The Journal of Biological Chemistry」(4月11日号)
- 論文タイトル
- Structural and biochemical analyses of glycoside hydrolase family 26 β-mannanase from a symbiotic protist of the termite Reticulitermes speratus
- 著者
- Hikaru Tsukagoshi1, Akihiko Nakamura2, Takuya Ishida2, Kouki K. Touhara1, Masato Otagiri3, Shigeharu Moriya3, 4, Masahiro Samejima2, Kiyohiko Igarashi2, Shinya Fushinobu1, Katsuhiko Kitamoto1, and Manabu Arioka1
1 東京大学大学院農学生命科学研究科 応用生命工学専攻
2 東京大学大学院農学生命科学研究科 生物材料科学専攻
3 独立行政法人理化学研究所 環境資源科学研究センター バイオマス工学連携部門
4 横浜市立大学大学院先端医科学研究科 - DOI番号
- 10.1074/jbc.M114.555383
- アブストラクト
- http://www.jbc.org/content/289/15/10843
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 微生物学研究室
准教授 有岡 学
Tel:03-5841-8230
Fax:03-5841-8033
研究室URL:http://park.itc.u-tokyo.ac.jp/Lab_Microbiology/
用語解説
- 注1 ヤマトシロアリ(Reticulitermes speratus)
- 日本にごく普通に生息するシロアリであり、枯れ木や朽ち木を食べ、その内部に巣を作る。
- 注2 X線結晶構造解析
- タンパク質にX線をあて、散乱したX線を測定することによりタンパク質の3次元構造を知ることができる解析方法。
- 注3 (β/α)8 TIMバレル
- タンパク質の構造を示す。この場合はαへリックスとβストランドそれぞれ8個で構成されたタンパク質である。