ゲ ノム探索により32員環からなる新規チオペプチドを発見 - 細菌ゲノムの解読から、創薬応用へ期待 -
- 発表者
-
林 昌平(東京大学大学院農学生命科学研究科 微生物潜在機能探索寄付講座 特任研究員;当時)
尾﨑 太郎(東京大学大学院農学生命科学研究科 微生物潜在機能探索寄付講座 特任助教)
浅水 俊平(東京大学大学院農学生命科学研究科 微生物潜在機能探索寄付講座 特任助教)
池田 治生(北里大学北里生命科学研究所 微生物制御工学研究室 教授)
大村 智(北里大学 特別栄誉教授)
奥 直也(富山県立大学工学部 微生物工学研究室 助教)
五十嵐 康弘(富山県立大学工学部 微生物工学研究室 教授)
供田 洋(北里大学薬学部 微生物薬品製造学研究室 教授)
尾仲 宏康(東京大学大学院農学生命科学研究科 微生物潜在機能探索寄付講座 特任教授)
発表のポイント
◆細菌ゲノムの解読から、通常は発現していない抗生物質を作る遺伝子を発見し、その化合物をラクタゾールと名づけました。
◆ラクタゾールは環状構造のサイズやアミノ酸の組成が既知の抗生物質と類似性が低く、遺伝子数も少ないため、遺伝子組換えなどの遺伝子操作に適していることが示唆されました。
◆今回の発見によって、チオペプチドの構造レパートリーが拡大したことにより、新たなチオペプチド系抗生物質開発への期待が高まります。
発表概要
土壌中に住む細菌の一種、放線菌(注1)は結核の特効薬ストレプトマイシンをはじめ、多様な抗生物質を作ることが知られています。しかし、放線菌が作る化合物の全貌は明らかになっていないため、放線菌において未知の化合物で新規の医薬品の礎となる新しい化学構造を有するものが発見される可能性があります。
東京大学大学院農学生命科学研究科の尾仲宏康特任教授、富山県立大学、北里大学らのグループは、抗生物質がきかない細菌(多剤耐性菌)に対しても抗菌作用を示すチオペプチド化合物(注2)の一種で、従来のものとは化学構造が大幅に異なる化合物を放線菌のゲノム探索(注3)と異種発現法(注4)を用いて発見しました。
ラクタゾールと命名した本化合物は、32の原子から構成される環状構造を有することやアミノ酸の組成などの点において、これまでに知られているチオペプチドと類似性が低いことが分かりました(図1)。また、ラクタゾールの合成に関わる遺伝子数は6個であり、従来報告されている最小のチオペプチド生合成遺伝子群に比べて半数程度とかなり少ない特徴がありました(図2)。この化合物は抗菌作用を示さなかったものの、骨形成に関わる遺伝子発現を阻害する効果が認められました。
チオペプチドは他の抗生物質と比較して、比較的容易に類縁化合物が作製できることに加えて、ラクタゾールは遺伝子数が少なく、遺伝子組換え等の遺伝子改変が容易であることから、ラクタゾールを基にした新たな抗生物質の開発など、今回の発見は今後の抗生物質を開発する上で基盤となる知見であります。
発表内容
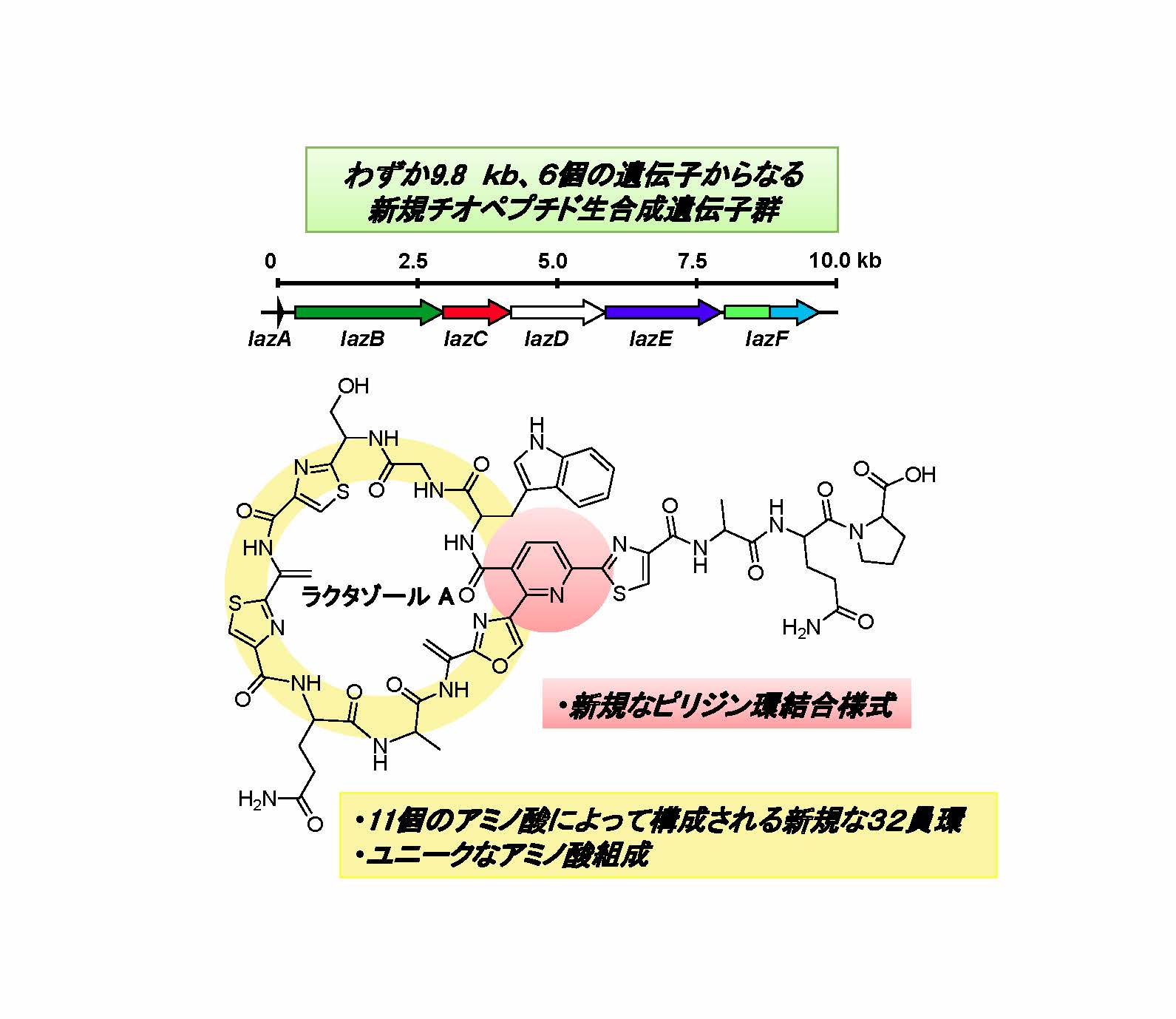
図1 今回新たに発見されたラクタゾール生合成遺伝子群(上)とラクタゾールAの化学構造(下)(拡大画像↗)
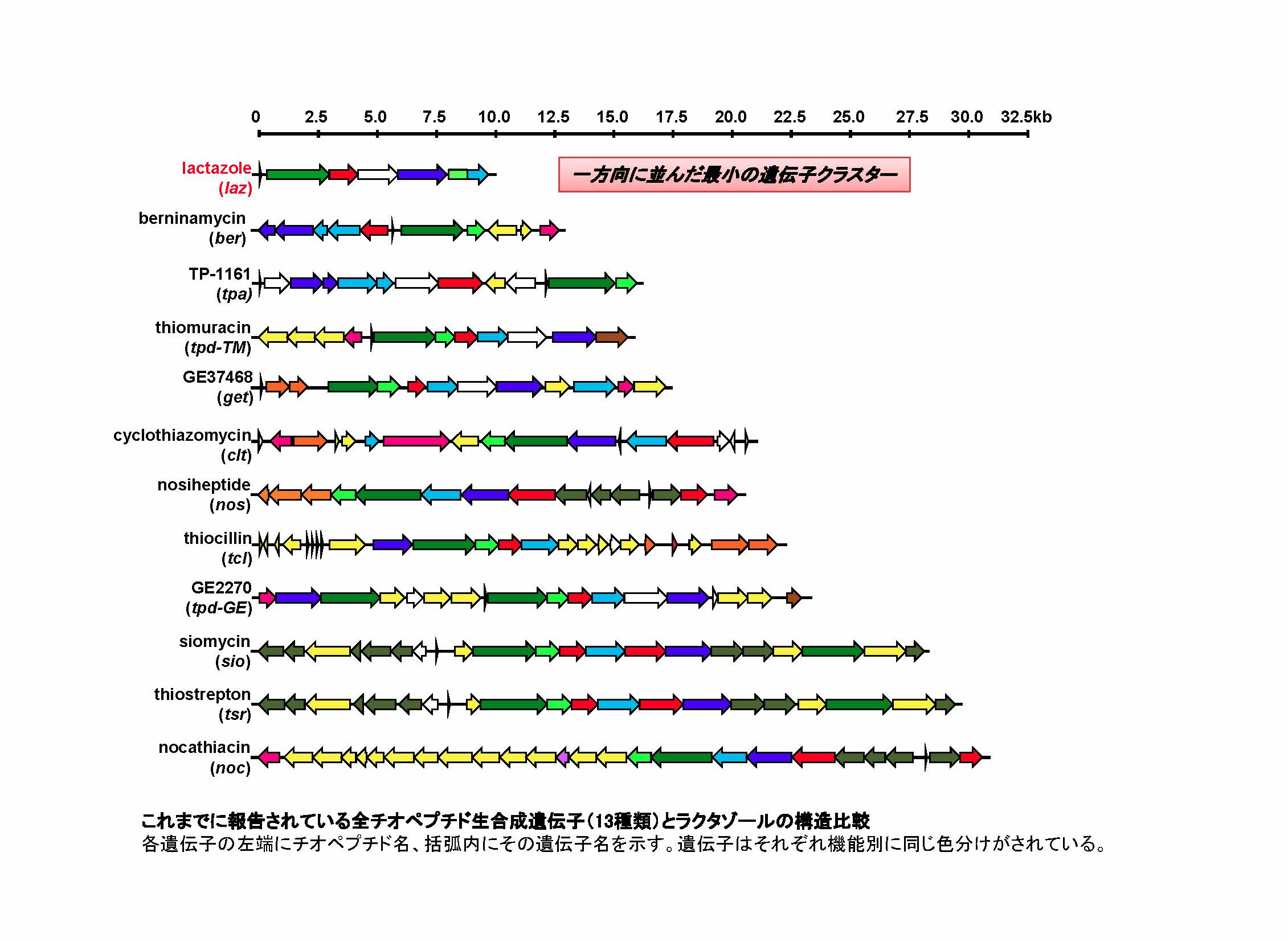
図2 これまでに報告されている全チオペプチド生合成遺伝子(11種類)とラクタゾール生合成遺伝子の比較。
各遺伝子の左端にチオペプチド名、括弧内にその遺伝子名を示している。遺伝子はそれぞれ機能別に同じ色分けがされている。ラクタゾールは最もコンパクトな遺伝子クラスターを形成し、遺伝子操作が他のチオペプチドに比べて容易であることが分かる。
(拡大画像↗)
放線菌は結核の特効薬であるストレプトマイシンをはじめ、多様な抗生物質を作ることが知られている土壌細菌です。このような性質から放線菌の探索を通して新規医薬品の礎となる新しい化学構造を有する天然物の発見が期待できます。今回、東京大学大学院農学生命科学研究科の尾仲宏康特任教授、富山県立大学、北里大学のグループは、抗生剤がきかなくなった細菌(多剤耐性菌)などに対して抗菌作用を有するチオペプチドと呼ばれる天然物群の中に、従来までのチオペプチド構造の枠組みを超えるユニークな化学構造を有するチオペプチドが存在することを明らかにしました。
放線菌Streptomyces lactacystinaeusのゲノムを解読した結果、本ゲノム中には6個の遺伝子だけからなる、これまでに類を見ない最小単位のチオペプチド生合成遺伝子群を見出しました。チオペプチドのペプチド骨格構造は、生物に普遍的に存在する蛋白質(ポリペプチド)合成装置であるリボソームにより合成されます。ペプチド骨格構造をコードする遺伝子の配列を予測した結果、既知のチオペプチドにはない構造上の特徴を有していることが推測されました。
Streptomyces lactacystinaeusがチオペプチド系化合物を生産しているという報告はこれまでなかったため、本チオペプチド生合成遺伝子群は、通常は発現していないサイレント遺伝子であることが予想されました。そこで、異種発現法を用いて、本遺伝子群を別種の放線菌であるStreptomyces lividansに移植したところ、新規チオペプチド化合物の生産が確認でき、その化学構造を決定することができました。
新規チオペプチドは14、16、17個のアミノ酸残基をベースにした3種の類縁体からなる化合物群で、それぞれlactazole A、 lactazole B、 lactazole C(ラクタゾール)と命名しました。これらのラクタゾールは、チオペプチド化合物の典型的な特徴であるピリジン環(注5)を要とする大員環を形成しアゾール環(注6)やデヒドロアラニンなどが分子内に存在する構造を有していました。しかしながら、大員環のサイズや構成するアミノ酸の種類、ピリジン環と隣接する化学構造が既知のチオペプチドとは異なっており、新しいタイプのチオペプチドであることが明らかとなりました(図1)。従来のチオペプチドは9、10、12個のアミノ酸で大員環を形成するものが知られていましたが、11個のアミノ酸で構成される32員環(32の原子が環状構造を形成)を有するチオペプチドはラクタゾールが初めての例でした。また、ラクタゾールを構成するアミノ酸にトリプトファンやグルタミンが含まれている点、ピリジン環と隣接してトリプトファンが連結している点も従来のチオペプチドには見られないラクタゾールにユニークな特徴でした。
ラクタゾールの生理活性を調べたところ、従来のチオペプチドに見られる抗菌活性は認められませんでしたが、骨形成に関与するタンパク質(BMP)を介したシグナル伝達系の阻害効果が確認されました。既存のチオペプチドと異なるこれらの性質は前述したラクタゾールのユニークな化学構造に起因している可能性が示唆されます。
ラクタゾールの生合成に関与する遺伝子群は染色体上に同じ方向に並んだ6個の遺伝子から構成されており、これは、少なくとも10個以上の遺伝子で構成されている従来のチオペプチド生合成遺伝子群と比較して、かなり単純な構成であることが分かりました(図2)。このような単純な遺伝子構成であるため、遺伝子組換えなどの遺伝子操作が容易となる利点があります。実際に、ラクタゾールの生合成に関与する遺伝子群の発現を増加させるような遺伝子操作を施したところ、当初観測されたラクタゾールの生産量は13 mg/Lであったのに対し、遺伝子操作後は343 mg/Lと約30倍まで生産量を増大させることに成功しました。また、ラクタゾールを構成するアミノ酸を置換する遺伝子操作を施し、これまでに2種類のラクタゾール類縁体の生産にも成功しています。このように、これまで知られているチオペプチドの中でもっとも単純な構造を有するラクタゾールの生合成システムを基盤に遺伝子組換え技術を適用することにより、多様なチオペプチドを高効率に製造できる可能性が高まりました。
今回、ゲノム探索によってラクタゾールが発見できたことから、新規抗生物質の発見にゲノム探索が有効であることが改めて示されました。また、ラクタゾールのような新規性の高いチオペプチドが見つかったことから、チオペプチドの化学構造は従来考えられていたよりも多様であることが分かり、より多様なチオペプチド構造が天然物に存在している可能性が高まりました。以上のことから、本発見を契機に遺伝子情報を基盤とした新たなチオペプチド系抗生物質や全身の骨や軟骨の難病である、進行性骨化性線維異形成症等の治療に有望な化合物の開発が期待されます。
本研究を中心となって行った東京大学大学院農学生命科学研究科 微生物潜在機能探索寄付講座は公益財団法人発酵研究所の寄付講座助成事業によって設立された寄付講座です。
発表雑誌
- 雑誌名
- 「Chemistry & Biology」(4月24日オンライン版)
- 論文タイトル
- Genome mining reveals a minimum gene set for the biosynthesis of 32-membered macrocyclic thiopeptides lactazoles
- 著者
- Shohei Hayashi, Taro Ozaki, Shumpei Asamizu, Haruo Ikeda, Satoshi Ōmura, Naoya Oku, Yasuhiro Igarashi, Hiroshi Tomoda, and Hiroyasu Onaka
- DOI番号
- 10.1016/j.chembiol.2014.03.008
- アブストラクト
- http://www.cell.com/chemistry-biology/abstract/S1074-5521%2814%2900114-8
問い合わせ先
東京大学大学院農学生命科学研究科 微生物潜在機能探索寄付講座
特任教授 尾仲宏康
Tel:03-5841-1602
Fax:03-5841-1608
研究室URL:http://microbial-potential.bt.a.u-tokyo.ac.jp/
用語解説
- 注1 放線菌
- 放射状に菌糸を生やして生育する細菌の一群で多様な種を有する。主に土壌中に広く生息し、環境中では有機物の分解者としての役目を果たしている。産業的には抗生物質を作る菌として知られており、結核の特効薬・ストレプトマイシンや抗生物質・エリスロマイシン、免疫抑制剤・タクロリムス、抗寄生虫薬・エバーメクチンなどの生産菌は放線菌である。
- 注2 チオペプチド系抗生物質
- チオペプチドはペプチド化合物の一種であるが、構造内にピリジン環を要とする大員環構造を有し、アゾール環やデヒドロアラニンなどの通常のアミノ酸構造とは違う構造を有する細菌が生産する天然物の一群。これまでに100種類以上が発見されている。そのほとんどのチオペプチドが抗菌活性を有しており、多剤耐性菌(MRSA, VRE)などにもきくことから、医薬品としての開発が期待されている。また、チオペプチドのペプチド骨格構造は、生物に普遍的に存在する蛋白質(ポリペプチド)合成装置であるリボソームにより合成されることから、骨格構造遺伝子の塩基置換により、容易に類縁体を作り出せる利点がある。
- 注3 ゲノム探索
- 生物のゲノム配列を、次世代シーケンサーなどを使用して解析し、その遺伝子情報から新しい遺伝子産物を同定する方法。天然物探索の分野においても、ゲノム探索技術は汎用されており、対象となる微生物のゲノムを解析し、その遺伝子情報から新規性の高い天然物の生合成遺伝子を選抜して解析するという流れで研究が行われる。
- 注4 異種発現法
- 種類の異なる細菌種に遺伝子を移植し、遺伝子発現を試みる方法。新規に見つかった遺伝子がその見つかった種では発現が確認できず、その産物も同定できない場合に、試みられる。異種菌には遺伝子操作が簡便な取り扱いやすい種が選ばれることが多く、放線菌においてはStreptomyces lividans等がよく使われる。
- 注5 ピリジン環
- 炭素原子5個と窒素原子1個で骨格を構成する6員環。チオペプチドではピリジン環の部分でペプチド鎖が結合しており、大員環形成の要となっている。また、チオペプチドが抗菌活性を生じるために重要な構造と考えられている。
- 注6 アゾール環
- 窒素原子1個を含む5員環。ラクタゾールにおいては窒素原子1個、酸素原子1個、炭素原子3個からなるオキサゾール環と窒素原子1個、硫黄原子1個、炭素原子3個からなるチアゾール環の二種類のアゾール環が存在している。これらの構造はチオペプチドにおいては、セリン、システインなどが修飾を受けることにより生成し、生理活性が生じるために重要な構造である。