保湿効果のある糖グリセロールを生産する酵素の構造を解明 - 「うるおい」をもたらす酵素のかたちと仕組み -
- 発表者
-
東原 幸起(東京大学大学院農学生命科学研究科 応用生命工学専攻 学部学生(当時)
現所属:米国ロックフェラー大学 大学院生)
仁平 高則(新潟大学大学院自然科学研究科 食品製造学研究室 特定研究支援者)
北岡 本光(農研機構食品総合研究所 食品バイオテクノロジー研究領域 上席研究員)
中井 博之(新潟大学大学院自然科学研究科 食品製造学研究室 助教)
伏信 進矢(東京大学大学院農学生命科学研究科 応用生命工学専攻 教授)
発表のポイント
◆塩湖として有名なカリフォルニア州モノ湖に生息する細菌から見つかった新しい酵素「グルコシルグリセロールホスホリラーゼ」の立体構造をはじめて明らかにしました。
◆「グルコシルグリセロールホスホリラーゼ」が、どのようにして複数の反応を触媒するのか、というメカニズムを解明しました。
◆化粧品の保湿効果や甘みを持つ安全な食品成分として利用される「グルコシルグリセロール」の大量生産が期待できます。
発表概要
グルコシルグリセロール(注1:GG)は化粧品などに含まれる保湿成分であると同時に、お酒や味噌などの発酵食品にも含まれる甘みを持つ食品成分です。近年の研究により、カリフォルニア州のモノ湖から同定された細菌から、GGの生成・分解を主反応とする酵素、グルコシルグリセロールホスホリラーゼ(注2:GGP)が初めて発見されました。さらにGGPは副反応としてGGを分解して得られるβグルコース−1−リン酸(注3:βG1P)を加水分解し、グルコースとリン酸を生成することが分かっていました。しかし、GGPの立体構造は未だ明らかになってはおらず、どのようにして複数の反応を触媒するのかが不明でした。
今回、東京大学大学院農学生命科学研究科の伏信進矢教授らの研究グループは、GGPの立体構造を、X線結晶構造解析(注4)により初めて明らかにしました。研究グループは、高エネルギー加速器研究機構(KEK)物質構造科学研究所のフォトンファクトリー(注5)を利用して測定し、GGPがグルコースと結合した構造と、別の分子と結合した2種類の状態のGGPの構造を決定しました(図1)。またコンピュータ解析によりβG1Pが結合した状態を推定し、GGPの反応前の状態・加リン酸分解後(第一反応後)・加水分解後(第二反応後)の三状態の構造的な知見を得ました(図2)。これらの構造から得られた情報を基にGGPが触媒する複数の反応のメカニズムを明らかにしました。
本成果を基に化粧品の保湿効果や甘みを持つ安全な食品成分として利用される「グルコシルグリセロール」の大量生産が期待できます。また、学術的には塩湖という塩分の濃度が非常に高い極限環境でGGPをもつ細菌がどのようにして生きているのか解明する手がかりとなりえます。
発表内容
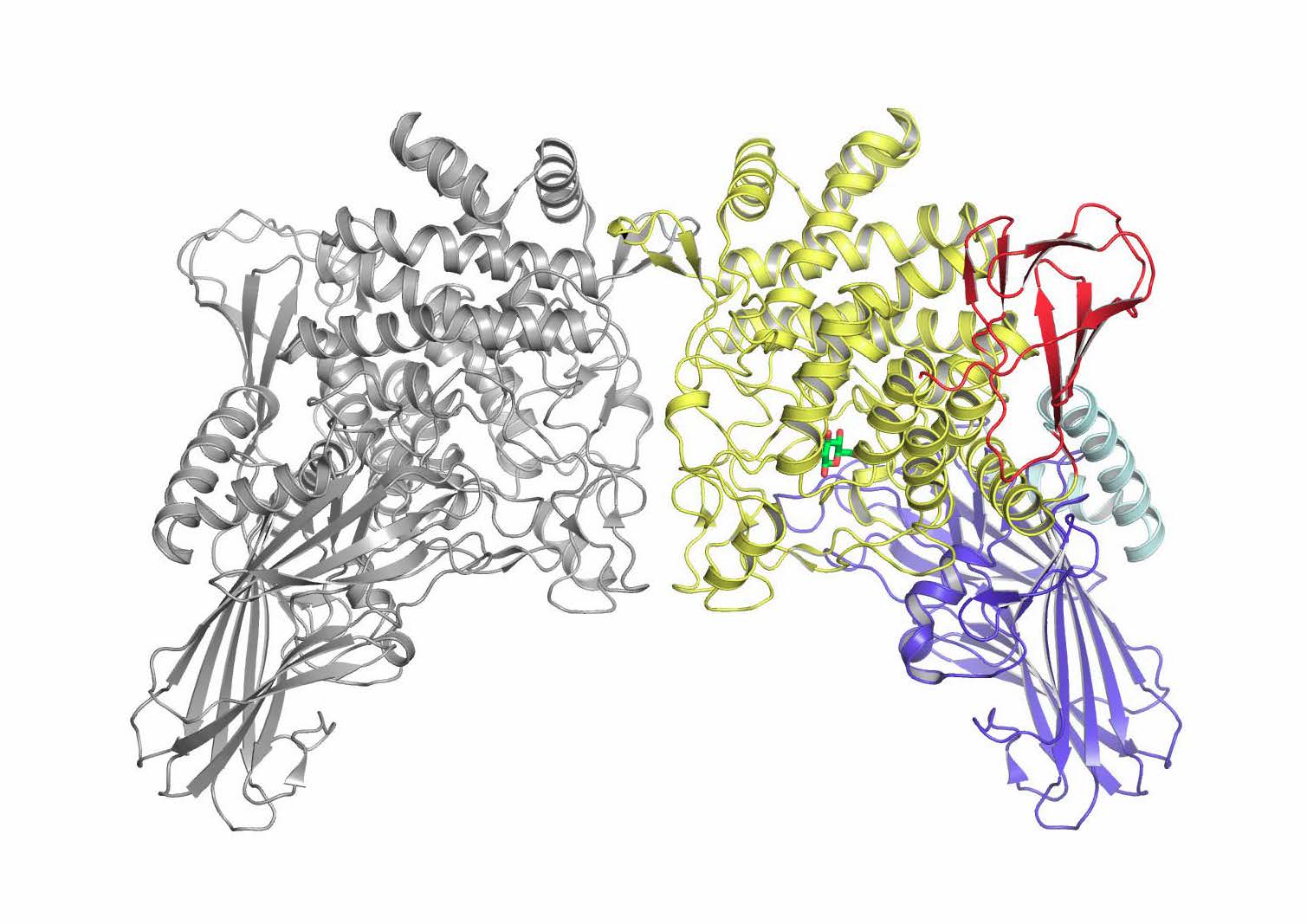
図1 GGPの全体構造(拡大画像↗)
GGPは二つの酵素分子が結合した状態で安定に存在する。左半分の灰色の部分と、右半分の色のついた部分がそれぞれ一つの酵素分子。右半分の酵素分子で触媒を担う黄色の部分には、緑と赤で表されたグルコースが表示されている。
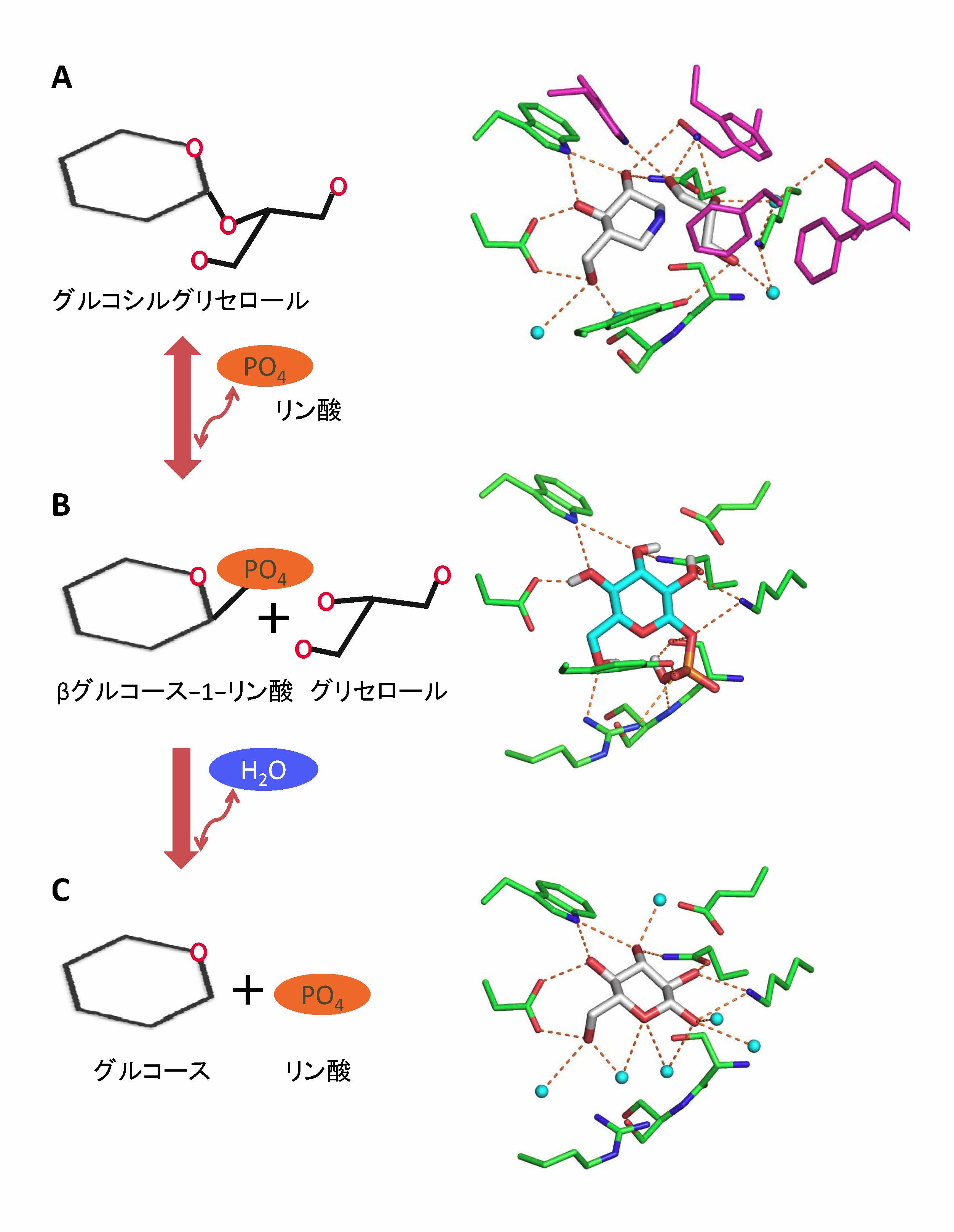
図2 GGPの反応前・第一反応後・第二反応後の触媒部位の構造 (拡大画像↗)
右図が実際の三次元構造で、左図はその模式図。
A:反応前の触媒部位の状態。右図で白で表されたイソファゴミンとグリセロールの結合状態はグルコシルグリセロールの結合した状態に対応している。紫で表されたアミノ酸残基はグリセロール部分を強く結合するために特徴的にデザインされたアミノ酸残基。水色の球は水分子を、オレンジの線は水素結合を表している。
B:第一反応後の状態。GGPの触媒部位の構造はβG1P(水色)のドッキング解析によって得た。
C:第二反応後の状態。最終生成物であるグルコースが結合した状態の構造を示している。
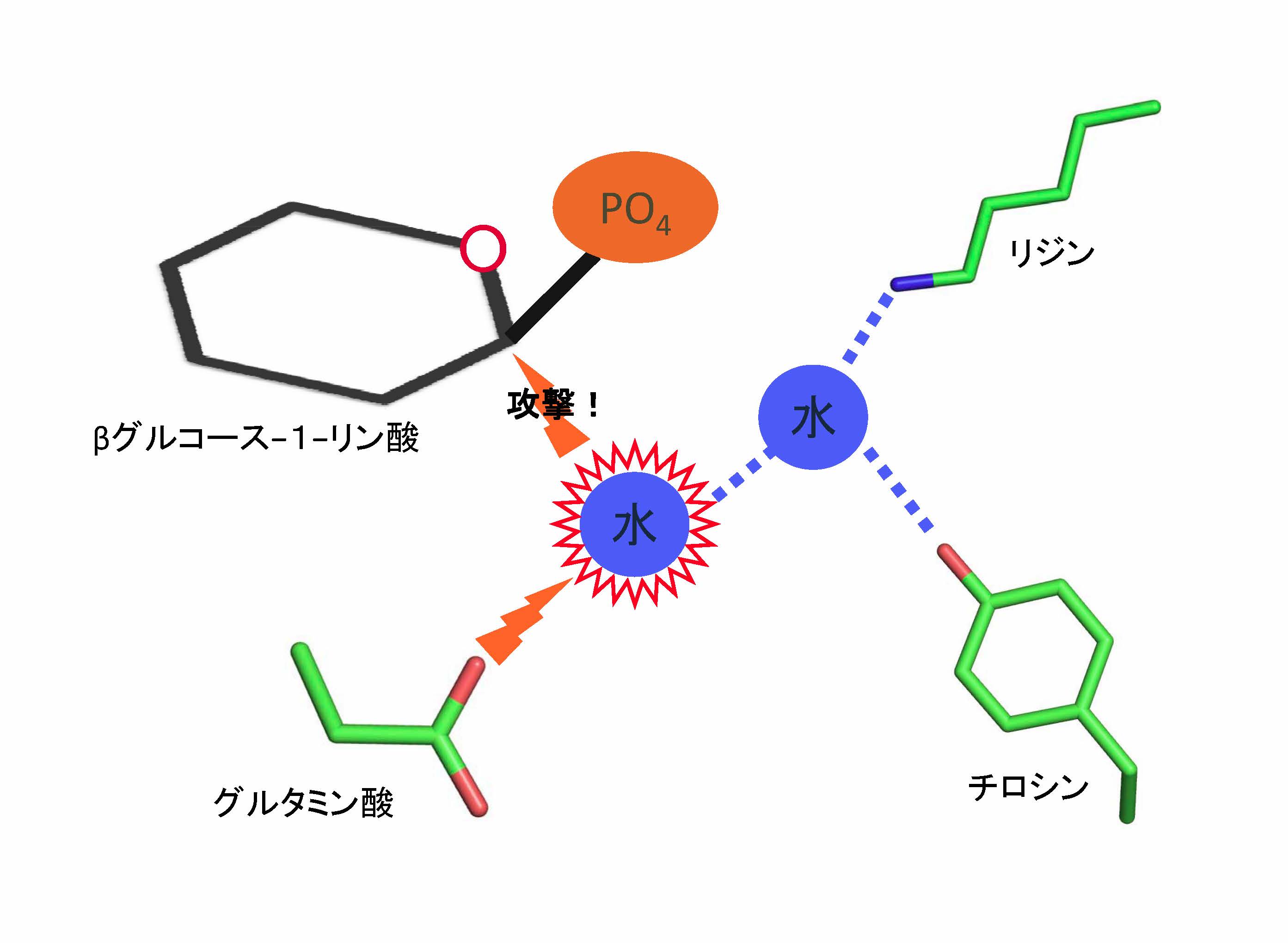
図3 今回提唱されたGGP酵素における加水分解反応の模式図(拡大画像↗)
βグルコース−1−リン酸(βG1P)が加水分解されるためには、水分子がリン酸とグルコースの間の炭素原子を攻撃する必要がある。しかし水はふらふらと動き回る分子のため、グルタミン酸による安定化だけではなかなか攻撃をしかけられない。しかし、リジンとチロシンによって安定化されたもう一分子の水が攻撃をしかける水分子を更に安定化させることによって、やっと攻撃を開始できる。
GGPは塩湖から同定された細菌(バチルス・セレニティレデュセンス)のゲノムから見つかった酵素であり、当初は機能が分かっていませんでした。しかしごく最近、本研究グループの一員でもある農研機構食品総合研究所の北岡本光上席研究員と新潟大学大学院自然科学研究科中井博之助教らのグループによりGGPがGGを加リン酸分解(注6)または生成するユニークな反応を持つ酵素であることが発見されました。また、この酵素はGGの加リン酸分解産物であるβG1Pを加水分解する活性も持つことも分かりました。しかし、GGPの立体構造は未だ明らかになってはおらず、どのようにして複数の反応を触媒するのかが不明でした。
このようにユニークな触媒活性を持つGGPの分子メカニズムを解明することは酵素学という分野において重要です。さらに、GGPによって生成できるGGは化粧品の保湿成分や甘みを持つ安全な食品成分として利用されており、私たちの生活に文字通り「うるおい」をもたらす可能性を秘めています。
今回、東京大学大学院農学生命科学研究科の伏信進矢教授のグループが中心となり、GGPの高分解能の三次元構造を、フォトンファクトリーのBL‐17Aを利用して、X線結晶構造解析の技術を用いて初めて明らかにしました。また、決定された構造とコンピュータ解析の結果を基に、新潟大学と農研機構食品総合研究所のグループと共同で点変異体(注7)を用いた機能解析を行い、GGPの反応のメカニズムを解明しました。
まず、GGPの触媒部位に一連の反応の最終生成物であるグルコースが結合した構造(図1)と、反応前の状態を模したイソファゴミン(注8)とグリセロールが両方結合した構造から、GGPのグリセロールが結合する部位は、GGがぴったりと結合できるような特徴的な構造であることが分かりました。さらに一反応ずつの複合体構造を予測するため、コンピュータを用いたドッキング解析(注9)を行い、GGPにβG1Pが結合した構造を推定しました。これらの解析により一連の反応の構造的な知見を得ました(図2)。その結果、GGを加リン酸分解する第一反応はGGPが属する酵素群に共通してよく知られている反応メカニズムであることが推定されました。一方、その反応の生成物であるβG1Pを加水分解する第二反応は類似の酵素群には見られないため、そのメカニズムは全く分かっていませんでした。加水分解が起こるためには、水分子がβG1Pのグルコースとリン酸をつなぐ炭素原子を攻撃しなければなりません。しかし水分子は常に動き回っており、何らかの作用によって安定化されなければ攻撃をしかけることができません。そこで研究グループは、この水分子の周辺のアミノ酸残基と、もう一つの水分子が、攻撃をしかける水分子を安定化しているのではないかという仮説を立て、その反応メカニズムを、点変異体を用いた機能解析によって明らかにしました(図3)。
通常一つの酵素は一つの反応を触媒しますが、GGPの場合は、本来の反応(加リン酸分解とその逆反応である合成反応)だけでなく、βG1Pの加水分解も触媒し複数の反応を触媒する点がユニークな特徴です。しかし、この加水分解活性は合成反応の基質でもあるβG1Pを壊してしまうために、GGPをGGの合成に応用しようとする場合には、障害にもなり得ます。本成果によって、GGPがどのようにして二つの反応を触媒しているかの分子メカニズムが明らかになり、βG1Pの加水分解反応をどのように抑えればよいかというヒントも得られました。
GGPにより生成できるGGは保湿効果があるだけでなく、麹菌の酵素の副反応によっても作られるために、お酒や味噌などに微量に含まれており、甘みを持ち、食品としても安全な物質であることが知られています。したがって、将来的には、化粧品や食品への添加物として大量生産への応用が期待されます。学術的にはGGPが細菌でどのような生物学的意味を持つのかは未だ不明ですが、塩湖という高い浸透圧下の極限環境で生き残るための戦略の一環としてGGPが利用されている可能性もあるため、細菌がどのようにして生きているのかを解明する手がかりとなりえます。
なお、本研究は、農林水産省の農林水産業・食品産業科学技術研究推進事業「酵素工学を活用した糖質資源高度利用プラットフォーム構築」による支援を受けて行われました。
発表雑誌
- 雑誌名
- 「The Journal of Biological Chemistry」(オンライン版2014年5月15日)
- 論文タイトル
- Structural basis for reversible phosphorolysis and hydrolysis reactions of 2-O-α-glucosylglycerol phosphorylase
- 著者
- Kouki K. Touhara, Takanori Nihira, Motomitsu Kitaoka, Hiroyuki Nakai, and Shinya Fushinobu
- DOI番号
- 10.1074/jbc.M114.573212
- アブストラクト
- http://www.jbc.org/content/early/2014/05/14/jbc.M114.573212.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 酵素学研究室
教授 伏信 進矢
Tel:03-5841-5151
Fax:03-5841-5151
研究室URL:http://enzyme13.bt.a.u-tokyo.ac.jp/
用語解説
- 注1 グルコシルグリセロール
- グルコースとグリセロールが結合した糖グリセロール。
- 注2 グルコシルグリセロールホスホリラーゼ
- リン酸を基質としてグルコシルグリセロールを加リン酸分解あるいはその逆反応(合成反応)を触媒する酵素。ホスホリラーゼとは加リン酸分解(注6)反応を触媒する酵素のことであり、一般的にその逆反応(合成反応)も効率よく触媒する。
- 注3 βグルコース−1−リン酸(βG1P)
- リン酸とグルコースの一番炭素がβ結合した糖リン酸。
- 注4 X線結晶構造解析
- 酵素を含むタンパク質の立体構造を明らかにするための最も一般的な方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることができる。
- 注5 フォトンファクトリー
- 光(Photon)の工場(Factory)の愛称で親しまれているフォトンファクトリー(PF)は、日本初のX線を利用できる放射光専用光源として1982年に完成した。大学や研究機関が共同で利用実験するための施設(大学共同利用機関)としてKEKで運用され、年間約3千名を超える国内外の研究者が実験に訪れ、物質科学・生命科学の基礎から応用に至る世界最先端の研究成果を創出している。
- 注6 加リン酸分解
- 水を用いて化合物を分解する加水分解とは異なり、リン酸を用いて化合物を分解する反応。
- 注7 点変異体
- 酵素の特定のアミノ酸残基を別のアミノ酸残基に置換したもの。目的の残基に変異を入れることで酵素の活性が変われば、その残基の役割を推定できる。
- 注8 イソファゴミン
- グルコースによく似ており、GGPの触媒を担う部分に強く結合することにより酵素の働きを阻害する。
- 注9 ドッキング解析
- コンピュータ解析によって基質と酵素がどのように結合するかを予想する方法。