宿主のウイルス排除網をかいくぐれ ~宿主発の分解指令を阻止するウイルスタンパク質発見:阻止の様子可視化に成功~
- 発表者
-
岡野 夕香里 (東京大学大学院農学生命科学研究科 生産・環境生物学専攻 日本学術振興会特別研究員)
(現在:静岡大学大学院農学研究科 共生バイオサイエンス専攻 特任助教)
難波 成任 (東京大学大学院農学生命科学研究科 生産・環境生物学専攻 教授)
発表のポイント
◆植物には、ウイルスに感染するとそれを「認識➡記憶➡分解」し排除する防御機構があり、特に「記憶」の過程で植物体全身にウイルス感染の警報を発し続ける重要な役割があります。
◆この防御機構の「記憶」の過程に対抗する植物ウイルス側のタンパク質を発見し、その働きを初めて視覚的に捉えました。
◆植物ウイルスに対する標的薬剤を開発して食糧生産被害の低減や、ヒトに感染するウイルスの特効薬の開発につながることが期待されます。
発表概要
遺伝子を分解し、その機能発現を抑える「遺伝子抑制」は、細菌から菌類・酵母・動植物に至るまで広く生物に見られる現象です。役割を終えた遺伝子(メッセンジャーRNA、注1)を分解し遺伝子発現プログラムを円滑に進めるほか、「ウイルス(異物)などの感染」に対する防御機構(分子免疫、RNAサイレンシング)としても重要な役割を果たすことが知られています。この機構には「異物の情報を記憶」する重要な過程があり、感染した異物が全身に移行するのを抑えるために、宿主が全身に異物の情報を知らせます。同時に異物にはこの情報が伝達されることを阻止する戦略が異物の感染拡大に必須であり、一般にウイルスは宿主の防御機構を阻害するタンパク質(RNAサイレンシングサプレッサー)を持っています。しかし、その防御機構のうち「記憶」の過程を阻害し、かいくぐる仕組みはこれまで不明でした。
今回、東京大学大学院農学生命科学研究科の岡野夕香里研究員(当時)と難波成任教授らの研究グループは、植物ウイルスのタンパク質(TGBp1)が植物において「記憶」の過程を阻害するタンパク質であることを初めて明らかにしました。TGBp1は、ウイルスに感染した植物が異物の情報として「記憶」のために合成する二本鎖RNA(注2)を合成するタンパク質の複合体に結合し、それらを細胞質中で取り囲み凝集させていました。研究グループは、この様子を特殊な高解像度・高感度レーザー顕微鏡により視覚的に捉え、ウイルスはTGBp1により自らを異物と認識する植物の「記憶」の過程を阻害し、植物体全身への感染を可能にしていると結論づけました。
世界の作物に発生する病害のうち、その1/4以上が植物ウイルスによることが知られています。抗ウイルス薬の開発はこれまで成功していませんが、本研究成果により、RNAサイレンシングサプレッサーの標的薬剤を開発すれば、植物免疫を強化する、これまでと異なる新たなウイルス特効薬を開発し、病気に強い作物を作ることが可能になると期待されます。
最近、ヒトなど哺乳類においてもウイルスがほ乳類の防御機構であるRNAサイレンシングを抑制することが報告されています。本研究成果によりヒトに感染するウイルスの特効薬開発にもつながることが期待されます。
発表内容
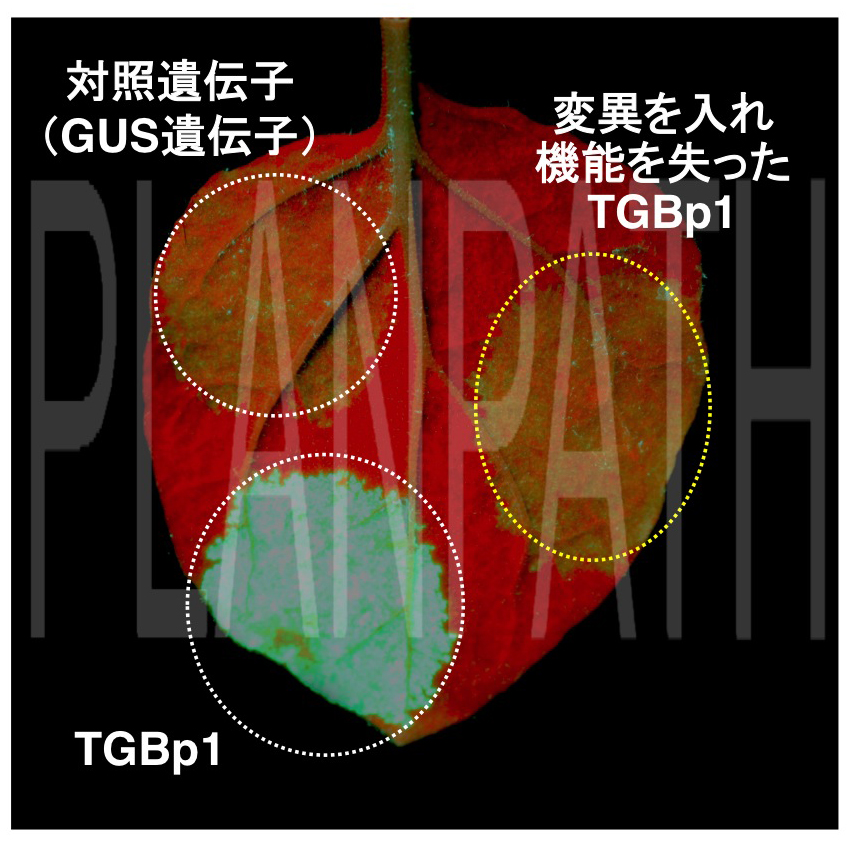
図1 TGBp1の機能(拡大画像↗)
植物の葉にクラゲの蛍光タンパク質(GFP:緑色)遺伝子を入れると、植物は異物として認識し分解する。この防御機構を阻止するウイルスタンパク質(TGBp1)を一緒に入れると、この分解機構(GFP遺伝子を分解する標的の異物情報として記憶する)を封じ込めるため、GFP遺伝子の分解が阻止され、緑色のGFP蛍光を発する。これに対して、変異を入れ機能を失ったTGBp1を入れても分解機構を阻止できず、対照として入れたGUS遺伝子同様、GFPタンパク質は分解され、蛍光は発しない。
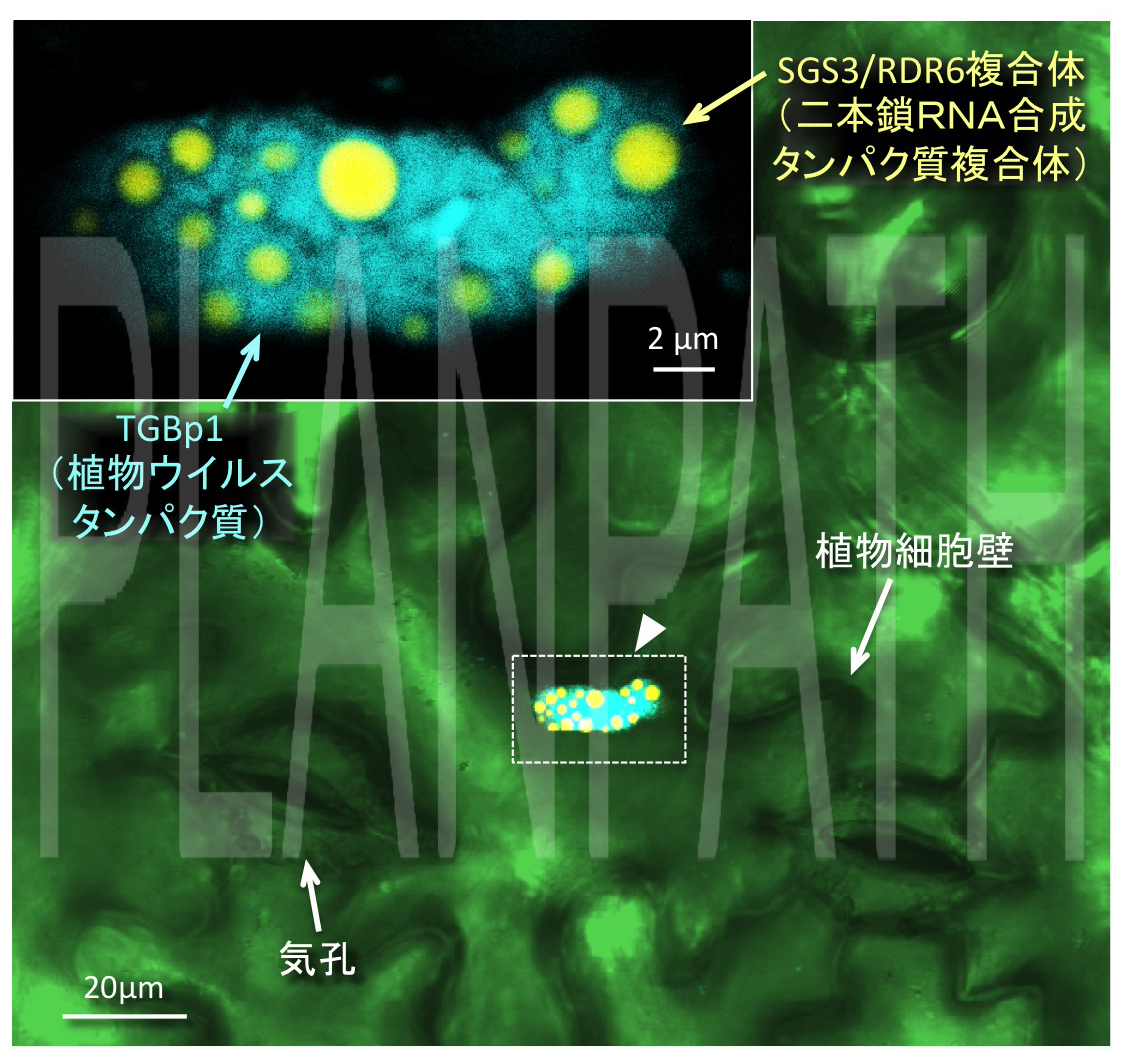
図2 植物ウイルスタンパク質(TGBp1:青)が植物ウイルスの二本鎖RNA合成タンパク質複合体(ウイルスRNAを異物情報として記憶する:黄)を封じ込め、働きを阻害する様子(矢頭は封じ込めた構造体)(拡大画像↗)
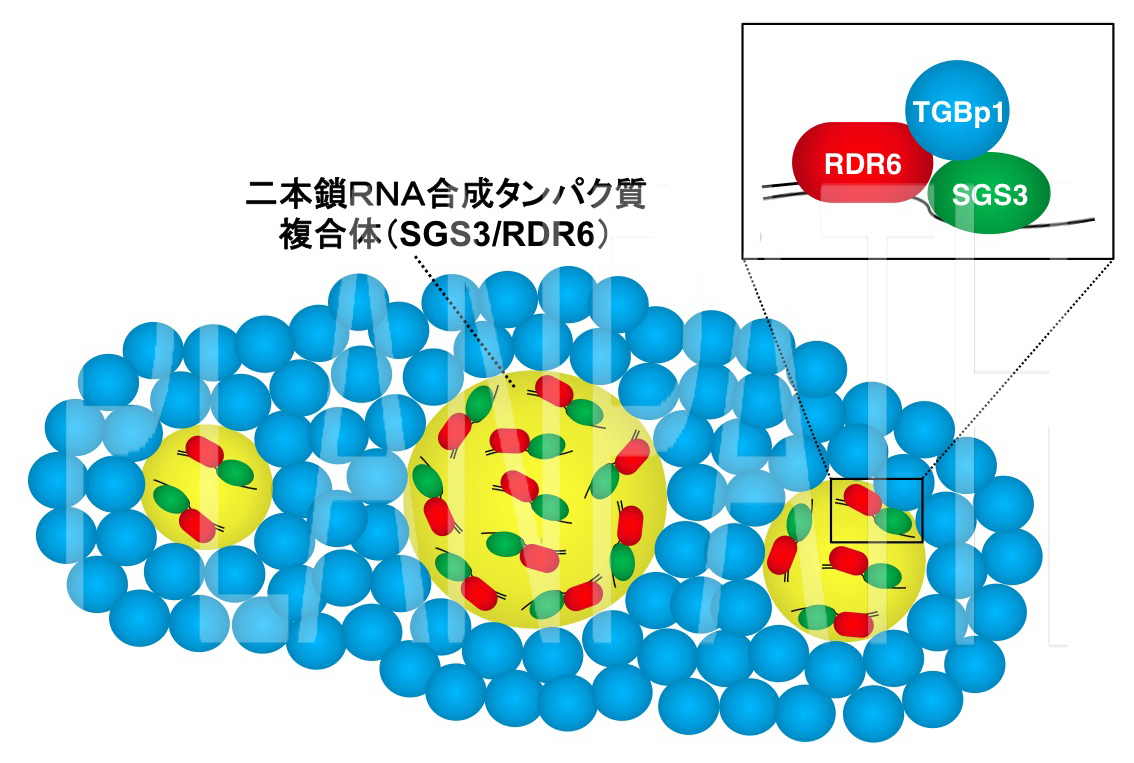
図3 植物ウイルスタンパク質(青)が植物ウイルスの二本鎖RNA合成タンパク質複合体(黄)を封じ込め、働きを阻害するモデル図(拡大画像↗)
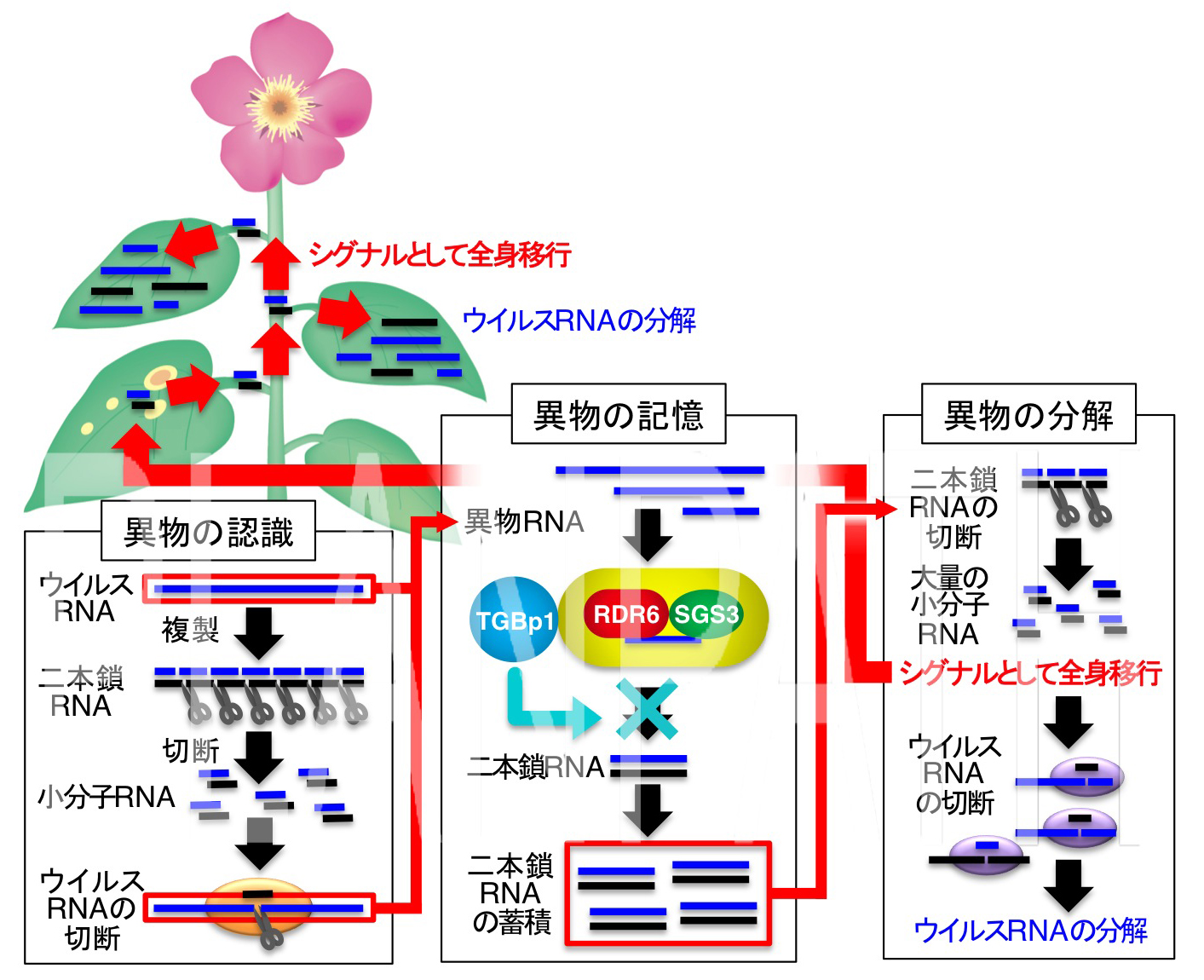
図4 RNAサイレンシングの3つのステップとTGBp1による二本鎖RNA合成の阻害(拡大画像↗)
①研究の背景・先行研究における問題点
RNAサイレンシングの発見は、2006年のノーベル生理学・医学賞が与えられ(注3)、細菌から酵母・動植物に至るまで広く見られる現象として注目を浴びています。RNAサイレンシングのうち、ウイルス感染に対する防御応答機構として働くものは古くから植物で知られており、2013年には、哺乳類でも発見されました。また、動植物とは大きく異なる遺伝子発現機構をもつ細菌においても、CRISPR/Casシステム(注4)と呼ばれるRNAサイレンシングに似たウイルス防御機構が近年発見されています。このようにRNAサイレンシングは、生物で普遍的に働く防御応答メカニズムである可能性が高まります。
ウイルスの防御機構として働くRNAサイレンシングは3つのステップからなります(注5)。まず、ウイルスに感染した宿主は「(1) 異物の認識」の過程でウイルスが生物の細胞内に侵入し、その遺伝情報を複製する過程で生じる二本鎖のRNAを異物として認識し、切断します。こうして生じた二本鎖の短いRNA(小分子RNA)(注6)は一本鎖になったのちに元の長いウイルスゲノムを認識して切断し、一本鎖RNAを生じます。次に、「(2) 異物の記憶」の過程で、これらの一本鎖RNAは異常なRNAと宿主に認識され、一本鎖RNAをもとにRdRp(RNA合成酵素、注7)が二本鎖RNAを大量に合成します。こうしてできあがった二本鎖RNAは異物の遺伝情報として記憶されます。また、この二本鎖RNAは切断されて、小分子RNAが大量に合成され、全身に異物の情報として伝わり、宿主はウイルスを待ち受けてその分解に備えるのです。最後に「(3) 異物の分解」の過程でウイルスゲノムと同じ配列を持つ小分子RNAが感染増殖した細胞内のウイルスゲノムと結合・分解しウイルス感染は阻止されます。
これに対し、ウイルスはRNAサイレンシングをかいくぐる仕組みを備えています。このようなウイルスタンパク質は「RNAサイレンシングサプレッサー」と呼ばれ、「 (1) 異物の認識」や 「(3) 異物の分解」の過程を阻害することが知られています。しかし、「(2) 異物の記憶」の過程を阻害するウイルスタンパク質やその実体はこれまで不明でした。
②研究内容
今回、東京大学大学院農学生命科学研究科の岡野夕香里研究員(当時)と難波成任教授らの研究グループは、作物に大きな被害を与え問題となっているポテックスウイルス(plantago asiatica mosaic virus, PlAMV)(注8)のTGBp1と呼ばれるタンパク質が「RNAサイレンシングサプレッサー」の機能を持つことに着目しました(図1)。そして、このタンパク質がシロイヌナズナのRDR6(シロイヌナズナのRdRp)を欠損させた変異体と非常によく似た「葉の形を細くする」働きを持つことを発見しました。そこで、TGBp1を導入した植物体内(シロイヌナズナ)のRNAを解析した結果、TGBp1によりRdRpの働きを必要とする二本鎖RNAの合成が阻害されていることを明らかにしました。また、TGBp1を発現する植物もRDR6を欠損させた植物も、ウイルス感染に弱いことが分かりました。
二本鎖RNAの合成にはRDR6とSGS3と呼ばれるタンパク質が複合体(SGS3/RDR6)を形成して働くことが分かっていましたが、研究グループは、TGBp1がSGS3/RDR6と結合することを明らかにしました。さらに、蛍光標識されたタンパク質を用いてTGBp1とSGS3を染め分け、レーザー顕微鏡により両タンパク質の遺伝子を導入した植物細胞を観察したところ、TGBp1がSGS3/RDR6を包み込んでいることを発見しました(図2)。これらの結果から、TGBp1は二本鎖RNAを合成するタンパク質RDR6やSGS3と結合し、それらを細胞質中で凝集させることにより、二本鎖RNAの合成を阻害していることが示唆されました(図3)。
③社会的意義・今後の予定など
今回、ウイルスタンパク質のTGBp1が二本鎖RNAの合成を阻害し、自身のゲノムが異物として記憶されることを阻止していることを明らかにしました。これまで、RNAサイレンシングの「(2) 異物の記憶」の過程において中心的な役割を果たすRdRpが哺乳類のゲノムに存在しないことから、哺乳類ではこの過程が欠落しているとの見解が一般的でした。しかし最近、テロメラーゼ(注9)と呼ばれるタンパク質の複合体がRdRpの活性を持つことが明らかにされたことから、二本鎖RNAの合成による「(2) 異物の記憶」の過程も動植物を通じて普遍的なメカニズムである可能性が高まります。今回の成果で初めて「(2) 異物の記憶」の過程を阻害するメカニズムを発見したことは画期的な成果であり(図4)、植物以外の生物種においても同様のメカニズムでRNAサイレンシングを抑制し感染を広げるウイルスが存在すると予想され、本研究成果は幅広い波及効果を及ぼすと期待されます。また、今回の成果により、ウイルスタンパク質がRNAサイレンシングの3つのステップ、すなわち「(1) 異物の認識」、「(2) 異物の記憶」、「(3) 異物分解」の全ての過程において宿主の防御機構を阻害する仕組みを持つことが証明されました。
世界の作物に発生する病害のうち、その1/4以上が植物ウイルスによることが知られており、これは約3億人分の食糧に相当します。これまでにウイルス病に防除効果のある化学農薬は開発されておらず、植物ウイルスの防除は極めて困難です。本研究の成果を応用して、RNAサイレンシングサプレッサーを標的としてその機能を弱める薬剤を開発することができれば、植物が本来もつ耐病性を発揮させてウイルス病を抑制し、作物生産量を増加させることができる可能性が高まります。また、上述のように哺乳類に感染するウイルスがRNAサイレンシングサプレッサーをもつことも明らかにされつつあり、本研究の成果により、ヒトに感染するウイルスの特効薬開発につながることも期待されます。
発表雑誌
- 雑誌名
- The Plant Cell(米国の国際植物科学誌)
- 論文タイトル
- In plantarecognition of a dsRNA synthesis protein complex by a potexviral RNA silencing suppressor.
- 著者
- Yukari Okano, Hiroko Senshu, Masayoshi Hashimoto, Yutaro Neriya, Osamu Netsu, Nami Minato, Tetsuya Yoshida, Kensaku Maejima, Kenro Oshima, Ken Komatsu, Yasuyuki Yamaji and Shigetou Namba.
- DOI番号
- 10.1105/tpc.113.120535
問い合わせ先
東京大学大学院農学生命科学研究科 生産・環境生物学専攻 植物病理学研究室
教授 難波成任(なんば しげとう)
Tel:03-5841-5053
Fax:03-5841-5054
研究室URL:http://papilio.ab.a.u-tokyo.ac.jp/planpath/
用語解説
- 注1 セントラルドグマとメッセンジャーRNA
- 生物の遺伝情報はデオキシリボ核酸(DNA)の4つの塩基の配列として記録されていますが、DNAからタンパク質が合成されるまでの過程はセントラルドグマと呼ばれます。DNAは二本鎖を形成して安定な構造をとりますが、転写という反応により二本鎖DNAからほどかれた一本鎖DNAが鋳型となってメッセンジャーRNAと呼ばれる一本鎖のリボ核酸(RNA)に複製されます。メッセンジャーRNAに複製された遺伝情報をもとに、翻訳という反応によりさまざまな生理活性をもつタンパク質が合成されます。
- 注2 二本鎖RNA
- DNAからタンパク質が合成されるまでのセントラルドグマの中には二本鎖DNA、一本鎖DNA、一本鎖RNAとタンパク質は登場しますが、二本鎖RNAは登場しません。実際に、ウイルスや一部のRNAを除いて生物の細胞の中には二本鎖RNAは存在しないため、これらは異物として認識され、RNAサイレンシングによる分解を受ける対象となります。
- 注3 RNAサイレンシング
- RNAサイレンシングの現象を発見したアンドリュー・ファイアーとクレイグ・メローは2006年にノーベル生理学・医学賞を受賞しています。
- 注4 CRISPR/Casシステム
- 細菌がもつウイルスなどに対する防御システム。細菌にファージ(細菌ウイルス)が感染すると細菌はファージのDNAを約30塩基に切断し、自身のゲノムに組み込んでファージの配列情報を記憶します。そこから転写された小分子RNAはファージDNAと同じ配列情報を持つため、ファージDNAに結合することができます。小分子RNAはCasと呼ばれるDNA分解酵素と複合体を形成し、ファージDNAに結合・分解し、ファージ感染は阻止されます。
- 注5 RNAサイレンシングの3つのステップ
- 本発表ではウイルス防御機構として働くRNAサイレンシングのメカニズムが理解しやすいようにRNAサイレンシングのステップを「認識➡記憶➡分解」と記載していますが、現在では「認識➡分解➡記憶」の順とする記載が多くなっています。以前は「認識」のステップで生じた小分子RNAがプライマーとなってウイルスゲノムに結合し、RdRpによる二本鎖RNA合成(記憶)が行われると考えられていましたが、現在ではこのステップでは二本鎖合成ではなく切断が起こることが分かり、「分解」のステップとされているためです。次いでこれらのRNAは一本鎖となり、それをもとにRdRpによる二本鎖RNA合成(記憶)が起こると考えられています。しかし、基本的な反応プロセスは変わりません。
- 注6 小分子RNA
- 生物の細胞内に二本鎖RNAが侵入すると細胞内に存在するDicerと呼ばれるタンパク質がこれを察知し、結合・切断します。その結果、生じる21〜24塩基のRNAを小分子RNAと呼びます。Dicerは二本鎖RNAのみを切断する酵素で、種類によって異なりますが二本鎖RNAを21〜24塩基の特定の長さごとに賽(サイコロ:Dice)の目切りにすることから、Dicerと名付けられました。小分子RNA は、RNAサイレンシングのさまざまな過程で重要な役割を果たします。
- 注7 RdRp(RNA合成酵素)
- 二本鎖RNAを合成する働きを持つ酵素であり、一本鎖RNAを鋳型として二本鎖RNAを合成します。モデル植物のシロイヌナズナではRDR6と呼ばれるRdRpがRNAサイレンシングにおいて重要な働きをすることが分かっています。また、RDR6はSGS3(Suppressor of Gene Silencing 3)と協調的に働くことが明らかにされています。
- 注8 ポテックスウイルス
- ひも状粒子をもつ1本鎖RNAをゲノムとする大きな植物ウイルスグループで、ポテックスウイルス属と呼ばれます。ポテックスウイルスには35種7暫定種が含まれ、ウイルス粒子は幅13 nm(ナノメートル)長さ470-580 nmのひも状粒子です。代表的なウイルスとして世界中でジャガイモに感染し、さまざまな他属のウイルスと重複感染して激しい被害を引き起こすジャガイモXウイルスや、約10年前にヨーロッパで発生して以来急速に北米・南米などに感染範囲を拡大しトマト生産に甚大な被害を与えているペピーノモザイクウウイルス、観賞用に珍重されるランの主要ウイルスであるシンビジウムモザイクウイルス、日本のユリ生産に大きな被害を与えるPlAMVなどが含まれます。
- 注9 テロメラーゼ
- RNAを鋳型としてDNAを合成する逆転写酵素と呼ばれるタンパク質の一種。酵母からヒトに至るまで生物の染色体の末端にはテロメアと呼ばれるDNAの繰り返し配列があり、細胞分裂や細胞老化に関わります。テロメラーゼはテロメア配列を伸長させる働きを持ち、一本鎖RNAから一本鎖DNAを合成する逆転写酵素と呼ばれるタンパク質の機能を持ちます。