筋ジストロフィーの症状を再現したラットを作製 - 筋ジストロフィー研究に新たなモデル動物 -
- 発表者
-
中村 克行(東京大学大学院農学生命科学研究科 獣医学専攻 博士課程4年 日本学術振興会特別研究員)
藤井 渉(東京大学大学院農学生命科学研究科 応用動物科学専攻 助教)
山内 啓太郎(東京大学大学院農学生命科学研究科 獣医学専攻 准教授)
西原 真杉(東京大学大学院農学生命科学研究科 獣医学専攻 教授)
発表のポイント
◆遺伝子改変技術CRISPR/Cas法(注1)を用いてジストロフィン遺伝子に変異をもつラットの作製に成功した。
◆このラットではヒトの筋ジストロフィーに特徴的な筋肉の脆弱化や心臓、横隔膜の変性像が観察された。
◆このラットは、筋ジストロフィーの治療法開発に向けた有用な新規モデル動物となることが期待される。
発表概要
東京大学大学院農学生命科学研究科の中村克行大学院生、藤井渉助教、山内啓太郎准教授、西原真杉教授らの研究グループは、新規遺伝子改変技術であるCRISPR/Cas法(注1)を用いて、ジストロフィン遺伝子に変異をもつラット(ジストロフィン遺伝子変異ラット)の作製に世界で初めて成功しました。
デュシェンヌ型筋ジストロフィー(DMD、注2)はX染色体上に存在するジストロフィン遺伝子の変異により引き起こされる遺伝性疾患で、新生男児約3500人に一人の割合で発症します。DMDでは筋組織の脆弱化の進行とともに筋力が低下し、運動不全や呼吸器機能低下、心不全といった重篤な症状を示します。これまでDMDを患ったマウスやイヌ(DMDモデルマウス、DMDモデルイヌ)が主にDMDの治療法を開発する研究に用いられてきました。しかし、DMDモデルマウスは繁殖・維持が容易であるものの症状がヒトのDMDに比べて軽度である一方、DMDモデルイヌはヒトのDMDに類似した重篤な症状を示すものの、繁殖・維持に多大な労力を要することがそれぞれ課題となっていました。
今回作製されたジストロフィン遺伝子変異ラットではジストロフィンタンパク質が消失しており、筋力低下とともに筋肉における筋線維の壊死、筋線維の再生像や横隔膜における変性像が確認できました。また、これまでDMDモデルマウスでは顕著でなかった心臓の変性も認められました。これらの病態はいずれもヒトDMDに極めて類似したものであることから、ジストロフィン遺伝子変異ラットは、今後DMDの治療法を開発する上での研究に非常に有用なモデル動物となることが期待されます。
発表内容
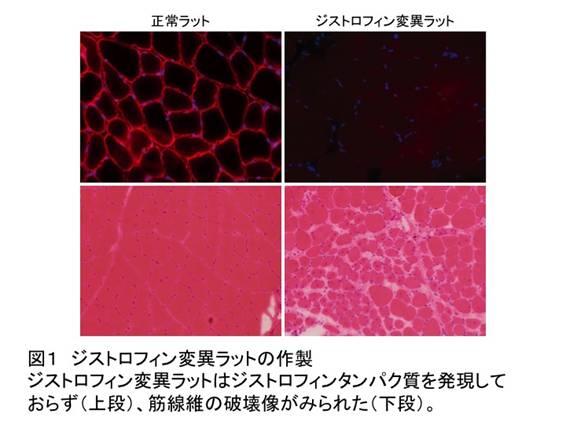
図1 ジストロフィン変異ラットの作製(拡大画像↗)
ジストロフィン変異ラットはジストロフィンタンパク質を発現しておらず(上段)、筋線維の破壊像がみられた(下段)。
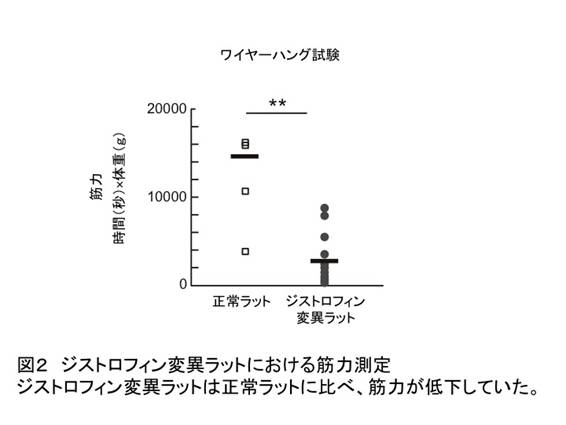
図2 ジストロフィン変異ラットにおける筋力測定(拡大画像↗)
ジストロフィン変異ラットは正常ラットに比べ、筋力が低下していた。
デュシェンヌ型筋ジストロフィー(DMD)はX染色体上に存在するジストロフィン遺伝子の変異によって引き起こされる遺伝性疾患で、新生男児約3500人に一人の割合で発症します。ジストロフィン遺伝子からつくられるジストロフィンタンパク質は、筋線維において細胞膜の安定性を担う重要な因子ですが、DMDではこのタンパク質の消失により、筋組織の脆弱化し、それによる筋力低下や運動不全、呼吸器機能低下ならびに心不全といった重篤な症状を示します。
DMDの治療法開発に向けた研究には、これまで主としてDMDを患ったマウスやイヌのDMDモデル動物が広く用いられてきました。しかしDMDモデルマウスは繁殖・維持が容易であるものの症状がヒトのDMDに比べて軽度である一方、DMDモデルイヌではヒトのDMDに類似した重篤な症状を示すものの、繁殖・維持に多大な労力を要することや個体差が大きいことがそれぞれ課題となっていました。
研究グループはDMDのモデル動物として、大きさがマウスとイヌの間であるラットに着目しました。ラットは繁殖・維持が容易であり、創薬開発の場でも特に薬効評価や毒性試験に多用されている学術的にも産業的にも重要な小型の実験動物です。近年ラットにおいてさまざまな遺伝子改変技術が確立されたことにより、目的の遺伝子を欠損したラットを作製できるようになりました。そこで、研究グループは新規ゲノム編集技術であるCRISPR/Cas法を用いてジストロフィン遺伝子に変異を導入することで、ジストロフィンタンパク質を消失したラットを作製し、そのDMDモデル動物としての有用性について検討しました。
ジストロフィン遺伝子に変異をもつラット(DMDラット)の筋肉におけるジストロフィンタンパク質の発現を調べたところ、正常ラットでみられる筋線維の細胞膜におけるジストロフィンタンパク質の発現がDMDラットでは消失しており(図1)、筋線維の破壊像や炎症細胞が多数現れる病変がみられました。また筋力を測定するワイヤーハング試験(注3)において、DMDラットは正常なラットに比べて筋力が低下していました(図2)。筋組織の変性は横隔膜にもみられ、さらに心臓においても、DMDモデルマウスでは顕著ではない心筋の壊死ならびに炎症細胞の出現といった病変を示すことが明らかとなりました。これらはいずれもヒトのDMDでみられる典型的な病態に類似したものです。続いてこのCRISPR/Cas法で導入されたジストロフィン遺伝子の変異がDMD親ラットから子ラットにも伝わるかどうかについて調べたところ、次世代の子ラットにおいてもジストロフィン遺伝子における変異が認められるとともに、親世代と同様なジストロフィンタンパク質の消失や筋線維の破壊像がみられました。
以上より、研究グループが作製したDMDラットはヒトのDMDの病態を反映することが明らかとなり、今後DMDの治療法を開発する上での研究に非常に有用なモデル動物となることが期待されます。
なお、本研究は、日本学術振興会科学研究費補助金の支援を受けて行われました。
発表雑誌
- 雑誌名
- 「Scientific Reports」7月9日
- 論文タイトル
- Generation of muscular dystrophy model rats with a CRISPR/Cas system
- 著者
- Katsuyuki Nakamura, Wataru Fujii, Masaya Tsuboi, Jun Tanihata, Naomi Teramoto, Shiho Takeuchi, Kunihiko Naito, Keitaro Yamanouchi* and Masugi Nishihara.
*責任著者 - DOI番号
- 10.1038/srep05635
- 論文URL
- http://www.nature.com/srep/2014/140709/srep05635/full/srep05635.html
問い合わせ先
東京大学大学院農学生命科学研究科 獣医学専攻 獣医生理学研究室
准教授 山内 啓太郎(やまのうち けいたろう)
Tel:03-5841-5387
Fax:03-5841-8017
研究室URL:http://www.vm.a.u-tokyo.ac.jp/seiri/index.html
用語解説
- 注1 CRISPR/Cas法
- DNAを切断する酵素と標的とする遺伝子の一部と相補的な配列をもつガイドRNAを用いることで、標的部位に変異を導入する遺伝子改変技術の一つ。
- 注2 デュシェンヌ型筋ジストロフィー(DMD)
- 筋ジストロフィーには、ジストロフィン遺伝子の変異パターンに応じて複数の種類があることが知られている。中でもジストロフィンタンパク質が完全に消失し、症状が重篤なデュシェンヌ型の頻度がもっとも高い。
- 注3 ワイヤーハング試験
- クッションの上にワイヤーを張り、そこにラットを吊るしてから落下するまでの時間を計測することで筋力を測定する方法。