ユニークな化学構造をもった天然化合物を作る仕組み - 4-メチルオキサゾリンを含むペプチド化合物の生合成機構の解明 -
- 発表者
-
アデリン ムリアンディ(東京大学大学院農学生命科学研究科 応用生命工学専攻 修士課程;当時)
勝山 陽平(東京大学大学院農学生命科学研究科 応用生命工学専攻 講師)
曽根 薫(東京大学大学院農学生命科学研究科 応用生命工学専攻 修士課程)
泉川 美穂(一般社団法人バイオ産業情報化コンソーシアム 研究員)
守屋 智博(東京大学大学院農学生命科学研究科 応用生命工学専攻 博士課程;当時)
小曽根 郁子(一般社団法人バイオ産業情報化コンソーシアム 研究員)
橋本 絢子(一般社団法人バイオ産業情報化コンソーシアム 研究員)
高木 基樹(一般社団法人バイオ産業情報化コンソーシアム 研究員;当時)
新家 一男(産業総合研究所 主任研究員)
大西 康夫(東京大学大学院農学生命科学研究科 応用生命工学専攻 教授)
発表のポイント
◆4-メチルオキサゾリンという珍しい環構造を含む非リボソームペプチド(JBIR-34, 35)の生合成遺伝子群を同定し、生合成経路を明らかにしました。
◆4-メチルオキサゾリンがアルファメチル-L-セリン由来であること、また、アルファメチル-L-セリンがD-アラニンから合成されることを明らかにしました。
◆本研究成果は遺伝子工学的手法によって生産することのできるペプチドのレパートリーの拡張につながるものであり、新規医薬品開発への貢献が期待されます。
発表概要
土壌細菌である放線菌は、抗生物質をはじめとしたさまざまな薬を生産する微生物として有名です。放線菌が生産する化合物は多種多様ですが、その中で一大グループを形成するのが非リボソームペプチド(注1)であり、バンコマイシンなどの有用な薬がこの化合物群の中から見つかっています。JBIR-34, -35は放線菌が生産する非リボソームペプチドであり、4-メチルオキサゾリンという珍しい環構造を有しています。東京大学大学院農学生命科学研究科と産業総合研究所の研究グループは、JBIR-34, -35の生合成遺伝子群を同定し、生合成経路の解析に取り組みました。その結果、4-メチルオキサゾリンがアルファメチル-L-セリン由来であること、また、アルファメチル-L-セリンがD-アラニンから合成されることを明らかにしました。これまでに遺伝子工学的手法によって、さまざまな非天然型の非リボソームペプチドを合成する研究がなされていますが、本研究成果は本手法によって生産することのできるペプチドのレパートリーの拡張に役立つものです。また、アルファメチル-L-セリンを取り込む非リボソームペプチド合成酵素(注2)やアルファメチルセリン合成酵素を同定できたことから、4-メチルオキサゾリン環を有する新しい非リボソームペプチドをゲノムマイニング(注3)により見出すことが可能になります。以上のことから、本研究成果は、将来、新規医薬品開発につながる可能性があり、基礎・応用の両面から重要なものです。
発表内容
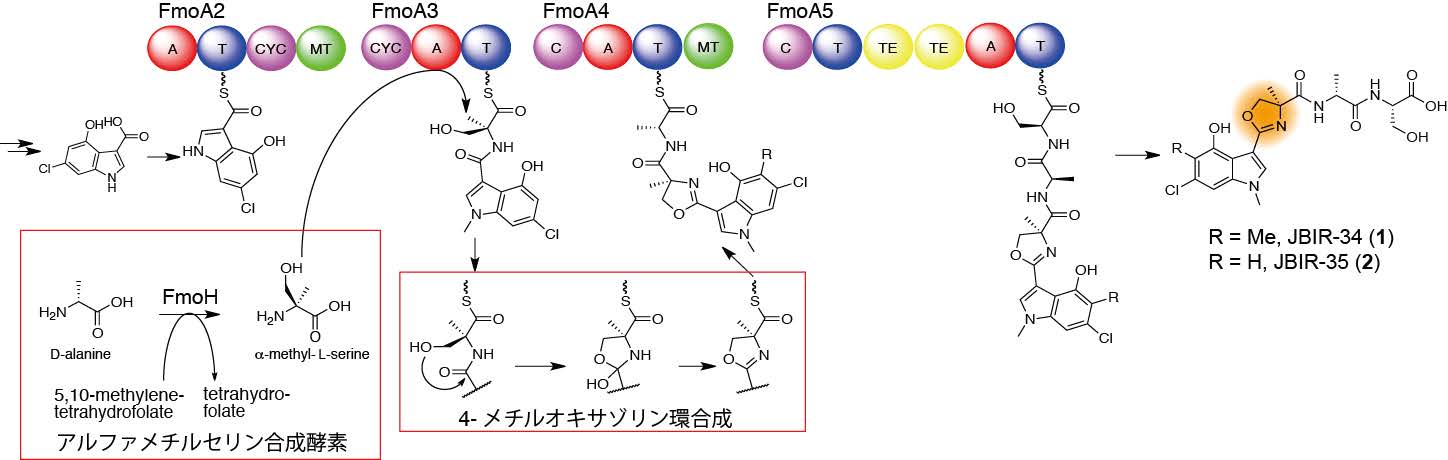
図 JBIR-34、-35の生合成経路。FmoHによって合成されたアルファメチルセリンは非リボソームペプチド合成酵素FmoA3に取り込まれ、ヘテロ環化によって4-メチルオキサゾリン環が合成される。JBIR-34、- 35はFmoA3を含む4つの非リボソームペプチド合成酵素からなる“組み立て装置”によって合成される。(拡大画像↗)
我々の医療にとって欠かせないのが薬です。近年では核酸医薬や抗体医薬などといった新しいタイプの薬が注目されていますが、これまで使われてきた抗生物質、抗がん剤、免疫抑制剤などの多くの薬は低分子化合物です。薬となる低分子化合物の多くは、植物成分や微生物代謝産物から見つけられてきました。放線菌と呼ばれる一群の土壌細菌は薬を作る微生物として大変有名です。放線菌は薬となる可能性を秘めた多種多様な化合物を生産する能力に長けているため、新しい薬を求めて、新規化合物を放線菌から単離する試みが世界中で行われています。放線菌が作り出す多様な化合物の中で、一大グループを形成するのが非リボソームペプチドです。メチシリン耐性黄色ブドウ球菌(MRSA)に効果がある抗生物質として有名なバンコマイシンやダプトマイシンも、非リボソームペプチドです。
JBIR-34, -35は産業総合研究所の新家一男主任研究員のグループが放線菌Streptomyces sp. Sp080513GE-23から単離した非リボソームペプチドであり、弱いラジカル消去活性(注4)を有する化合物です。この化合物は、天然では非常に珍しい4位にメチル基を有するオキサゾリン環(注5) (4-メチルオキサゾリン環) をもっています。天然に存在するオキサゾリン環はメチル基を持たないもの、もしくは5位にメチル基をもつもの(5-メチルオキサゾリン環)がほとんどです。5-メチルオキサゾリン環はスレオニン由来であることが示されていましたが、4-メチルオキサゾリン環がどのようにして合成されるかは全くわかっていませんでした。そこで、東京大学大学院農学生命科学研究科の大西康夫教授と産業総合研究所の新家一男主任研究員の研究グループは約5年前に共同研究を開始し、JBIR-34, -35の生合成機構の解明に取り組んできました。
JBIR-34, -35の生合成遺伝子を明らかにするために、Streptomyces sp. Sp080513GE-23のゲノムを解読しました。その結果、JBIR-34, -35の生合成に関わると思われる遺伝子群(fmo遺伝子群と命名)を見つけることに成功しました。fmo遺伝子群には非リボソームペプチド合成酵素をコードする5つの遺伝子が存在しました。これらの遺伝子情報の解析と安定同位体の取り込み実験などから、4-メチルオキサゾリン環はアルファメチル-L-セリンから合成されていることが示唆され、FmoHと名付けた酵素がアルファメチル-L-セリン合成酵素であると推測されました。そこで、組換えFmoHタンパク質を用いて試験管内反応を行ったところ、予想通り、FmoHがアルファメチル-L-セリン合成酵素であることが示されました。一方、非リボソームペプチド合成酵素についても解析を行い、FmoA3と名付けた酵素がアルファメチル-L-セリンを基質として好むことがわかりました。これらの結果からJBIR-34, -35の4-メチルオキサゾリン環は、FmoHにより合成されたアルファメチル-L-セリンが非リボソームペプチド合成酵素によって取り込まれて環化することで生成していることが明らかになりました(図参照)。
アルファメチルセリンを基質として用いる非リボソームペプチド合成酵素の同定は、本研究が初めてです。また、非リボソームペプチドの合成用に使われるアルファメチル-L-セリン合成酵素を詳しく解析したのも本研究が初めての例になります。これまでに遺伝子工学的手法によって、さまざまな非天然型の非リボソームペプチドを合成する研究がなされていますが、本研究成果は本手法によって生産することのできるペプチドのレパートリーの拡張に役立つものです。また、アルファメチル-L-セリンを取り込む非リボソームペプチド合成酵素やアルファメチルセリン合成酵素を同定できたことから、4-メチルオキサゾリン環を有する新しい非リボソームペプチドをゲノムマイニングにより見出すことが可能になります。以上のことから、本研究成果は、将来、新規医薬品開発につながる可能性があり、基礎・応用の両面から重要なものです。
発表雑誌
- 雑誌名
- 「Chemistry and Biology」(7月17日:オンライン版)
- 論文タイトル
- Biosynthesis of the 4-methyloxazoline-containing nonribosomal peptides, JBIR-34 and -35, in Streptomyces sp. Sp080513GE-23
- 著者
- Adeline Muliandi, Yohei Katsuyama, Kaoru Sone, Miho Izumikawa, Tomohiro Moriya, Junko Hashimoto, Ikuko Kozone, Motoki Takagi, Kazuo Shin-ya, and Yasuo Ohnishi
- DOI番号
- 10.1016/j.chembiol.2014.06.004
- アブストラクト
- http://www.cell.com/chemistry-biology/abstract/S1074-5521(14)00205-1
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 醗酵学研究室
教授 大西 康夫
Tel:03-5841-5123
Fax:03-5841-8021
講師 勝山 陽平
Tel:03-5841-5124
Fax:03-5841-8021
用語解説
- 注1 非リボソームペプチド
- アミノ酸がペプチド結合により重合した化合物のうち、高分子量のものはタンパク質、低分子量のものはペプチドと呼ばれます。すべての生物において、通常、タンパク質・ペプチドは、リボソームにおいてmRNAの翻訳によって生産されます。しかしながら、特殊な酵素がアミノ酸を重合することでペプチドが作られることもあります。リボソーム以外で合成されたペプチドは非リボソームペプチドと呼ばれます。
- 注2 非リボソームペプチド合成酵素
- 非リボソームペプチドを合成する酵素であり、NRPS (nonribosomal peptide synthetase) と呼ばれます。図に示したように、Aドメイン、Cドメイン、Tドメインなどの機能ドメインが集まってモジュールと呼ばれる単位を構成します。基本的に、1つのモジュールによって1つのアミノ酸が伸長され、非リボソームペプチドが順次組み立てられていきます。
- 注3 ゲノムマイニング
- 生物のゲノム配列を解析し、その遺伝子情報から新しい生合成遺伝子群探索し、その遺伝子群によって生産される化合物を同定するという手法。本手法により、多くの新規化合物が見出されるようになってきています。
- 注4 ラジカル消去活性
- ラジカルとは不対電子をもつ化合物の総称で高い反応性をもちます。活性酸素がその代表例であり、癌や老化等の原因であるといわれています。ラジカル消去活性とは、そのようなラジカルと反応しより安定で安全な物質へと変換する活性のことをいいます。
- 注5 オキサゾリン環
- 1原子の窒素と酸素、3原子の炭素からなる5員環構造(図参照)。