きのこ由来新規ピロロキノリンキノン(PQQ)依存性糖酸化酵素の発見
- 発表者
-
松村 洋寿(東京大学大学院農学生命科学研究科 生物材料科学専攻 学術振興会特別研究員PD
:現オレゴン健康科学大学 博士研究員)
梅澤 究(東京農工大学大学院連合農学研究科 環境資源共生科学専攻 博士課程1年 学術振興会特別研究員DC)
武田 康太(東京農工大学大学院 工学部 生命工学専攻 博士後期課程3年 学術振興会特別研究員DC)
杉本 直久(東京大学大学院農学生命科学研究科 生物材料科学専攻 農学特定研究員
:現新潟大学 若手研究者育成推進室 特任助教)
石田 卓也(東京大学大学院農学生命科学研究科 生物材料科学専攻 特任助教)
鮫島 正浩(東京大学大学院農学生命科学研究科 生物材料科学専攻 教授)
大野 弘幸(東京農工大学 工学部 生命工学科 教授)
吉田 誠(東京農工大学 農学部 環境資源科学科 准教授)
五十嵐 圭日子(東京大学大学院農学生命科学研究科 生物材料科学専攻 准教授)
中村 暢文(東京農工大学 工学部 生命工学科 教授)
発表のポイント
◆ピロロキノリンキノン(PQQ、図1)注1を補酵素(酵素の反応を助ける有機化合物)として利用する酵素の存在を、真核生物で初めて証明しました。
◆きのこの一種であるCoprinopsis cinerea(ウシグソヒトヨタケ)が、ヘム鉄とセルロース結合能に加えて未知のドメイン注2を持つことが分かり、そのドメインがPQQとカルシウムによって様々な糖を酸化することが明らかとなりました。
◆PQQはこれまでも新しいビタミンである可能性が指摘されてきましたが、それを補酵素として使う酵素の存在が真核生物では明らかとなっていませんでした。本発見から、PQQを利用する酵素が広く真核生物に存在している可能性が示されました。
発表概要
東京大学と東京農工大学の研究グループは、PQQ依存性の糖酸化酵素をきのこから初めて発見しました。今回発見された新しい酵素は、ヘム鉄を含むドメイン、PQQとカルシウムを用いて糖を酸化するドメイン、セルロース等の多糖に結合するドメインを分子の中に含む非常にユニークな酵素であることが分かりました。PQQを補酵素として用いるドメインは、真核生物において初めての発見です。
PQQはバクテリアなどの原核生物で補酵素として利用されている化合物で、その発見は1964年までさかのぼります。ある種のバクテリアはPQQを自分で合成することができますが、その種類は限られており、PQQを自分で合成できないバクテリアの場合は、合成できるバクテリアが作ったPQQを利用していることが知られています。このPQQのやりとりはバクテリア間でのみ行われていると長い間考えられてきましたが、2003年にPQQがヒトにとって新規のビタミンである可能性が提唱されました。その後も様々な議論が行われていますが、未だにPQQは新規ビタミンとして認定されていません。その理由の一つとしてPQQを補酵素として利用する酵素が、バクテリアからしか見つかっていないことが挙げられていました。
本研究グループは、長年きのこが細胞の外に生産する様々な酵素に注目して研究してきましたが、その過程でヘム鉄を含むドメイン(ヘムドメイン)とセルロース結合性を有するドメインに挟まれている未知のドメインを持つ酵素遺伝子を、Coprinopsis cinerea(ウシグソヒトヨタケ)というきのこの全ゲノム配列に見いだしました。その遺伝子をクローニングして、酵母に生産させた組換え酵素の特徴を調べてみたところ、PQQとカルシウムを反応液中に加えたときに糖を酸化することができる「PQQ依存性糖酸化酵素(sugar dehydrogenase、略してSDH)」であることがわかりました。
今回、真核生物から初めてPQQを補酵素として利用する酵素が見つかったことで、PQQを自分で合成できない(例えば人間などの)他の生物の酵素においても、PQQを補酵素として用いる未知の酵素が存在する可能性が示されました。
発表内容
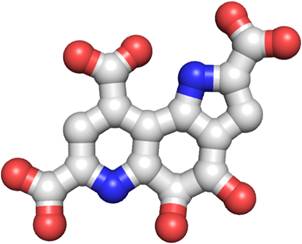
図1 PQQの化学構造
右上の五員環(五角形部分)がピロール構造、下部の二つの六員環(六角形部分)がキノリン構造。(拡大画像↗)
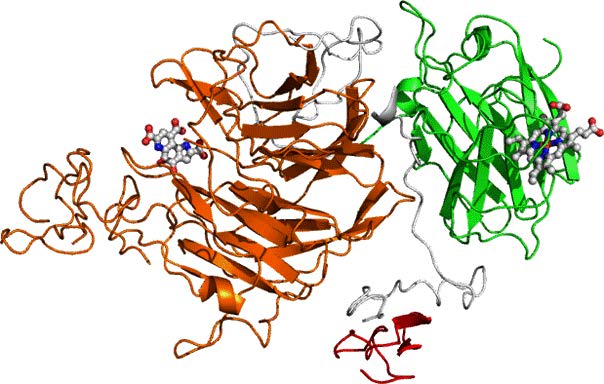
図2 CcSDHの推定3次元構造
緑色、オレンジ色、赤色はそれぞれヘムドメイン、PQQ依存性糖酸化ドメイン、セルロース結合性ドメインを示す。(拡大画像↗)
きのこは、生態系における分解者に位置づけられる生物で、様々な酵素を細胞の外に分泌して有機物を分解して消化し、成長するためのエネルギー源としています。このように多様な有機物を分解できるきのこの消化酵素系は、人間社会においてもバイオマス変換や環境浄化などに利用できると考えられることから、きのこの全ゲノム配列情報を駆使することで、化石資源の利用を少なくしたり、二酸化炭素の排出量を抑えたりすることが可能となると考えられています。
東京大学の五十嵐圭日子准教授と鮫島正浩教授は、植物細胞壁の主成分であるセルロースの分解に関わる酸化還元酵素である「セロビオース脱水素酵素」を20年以上に渡って研究してきました。その過程で、東京農工大学工学部の中村暢文教授・大野弘幸教授との共同研究が10年前にスタートし、セロビオース脱水素酵素に加えて様々な細胞外酸化還元酵素の電気化学的性質を明らかにしてきました。一方、東京農工大学の吉田誠准教授の研究室では、全ゲノム配列情報が公開されていたウシグソヒトヨタケを用いて、きのこの傘(子実体と呼ばれます)ができるメカニズムや、セルロース分解酵素が生産される仕組みなどを研究してきました。本研究では、長年共同研究を行ってきた三つのグループがそれぞれの長所を活かした結果、真核生物初のPQQ依存性糖酸化酵素の発見につながりました。
東京農工大学農学部では、ウシグソヒトヨタケの全ゲノム配列情報の中にセロビオース脱水素酵素のヘムドメインとよく似たタンパク質をコードする遺伝子を発見し、その組換えタンパク質の生産を東京大学が行いました。得られた組換えタンパク質は東京農工大学工学部と東京大学で性質を詳細に調べられ、その結果として図2に示すようなヘムドメインとPQQ依存性糖酸化ドメイン、さらにセルロース結合性ドメインがつながって一つの酵素となっていることが明らかとなりました。
CcSDHに対するPQQの解離定数(タンパク質とどの程度親和性があるかという指標)を等温滴定カロリメータという機械を使って調べたところ、1.11nM(ナノモーラー)という非常に低い濃度であることが分かり、PQQが本酵素に対して高い親和性を持つことが明らかとなりました。さらにPQQとカルシウムが存在しているときだけL-フコースという希少糖を酸化することもわかりました。
その他の生物がCcSDHに似た酵素を持っているかを調べたところ、バクテリアやきのこだけでなく、カビやアメーバなど他の真核生物もこの酵素の遺伝子を持っていることが明らかとなりました。今回発見されたPQQ依存性の酵素の場合は、比較的下等な真核生物にしか見いだされませんでしたが、これまでの解析では発見できなかったPQQ依存性の酵素が真核生物から見つかったということは、その他の生物においても未知のPQQ依存性の酵素が存在する可能性を示しており、真核生物おけるPQQの重要性が今後更に研究されると予想されます。
なおCcSDHの糖酸化ドメインは、糖関連酵素(Carobohydrate Active enZymes: CAZy)データベース内の新規補助活性(Auxiliary Activities, AAs)ファミリーに分類されることになりました(AAファミリー12、http://www.cazy.org/AA12.html)。また、本研究の一部は、日本学術振興会科学研究費補助金基盤研究(C)(研究代表者:中村暢文)、新学術領域研究「植物細胞壁の情報処理システム」(領域代表:東北大学 西谷和彦 教授、計画班研究代表者:五十嵐圭日子)、科学技術振興機構 先端的低炭素化技術開発(ALCA)(研究代表者:五十嵐圭日子)の補助を受けたものです。深く感謝いたします。
発表雑誌
- 雑誌名
- 「PLoS One」(オンライン版:8月14日)
- 論文タイトル
- Discovery of a Eukaryotic Pyrroloquinoline Quinone-Dependent Oxidoreductase Belonging to a New Auxiliary Activity Family in the Database of Carbohydrate-Active Enzymes
- 著者
- *Hirotoshi Matsumura(松村洋寿)、*Kiwamu Umezawa(梅澤 究)、*Kouta Takeda(武田康太)、Naohisa Sugimoto(杉本直久)、Takuya Ishida(石田卓也)、Masahiro Samejima(鮫島正浩)、Hiroyuki Ohno(大野弘幸)、†Makoto Yoshida(吉田 誠)、†Kiyohiko Igarashi(五十嵐圭日子)、†Nobuhumi Nakamura(中村暢文)
*共同筆頭著者,†責任著者 - DOI番号
- 10.1371/journal.pone.0104851
- 論文URL
- http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0104851
問い合わせ先
東京大学大学院農学生命科学研究科 生物材料科学専攻 森林化学研究室
准教授 五十嵐 圭日子(いがらし きよひこ)
Tel:03-5841-5258
Fax:03-5841-5273
E-mail:aquarius@mail.ecc.u-tokyo.ac.jp
用語解説
- 注1 ピロロキノリンキノン(Pyrroloquinoline quinone, PQQ)
- ニコチンアミド、フラビンと同様酵素の中に取り込まれることで、その酵素が酸化還元反応をできるようになる「補酵素」の一種。ピロール環とキノリン環が結合してできたキノンであることからこのような名前が付いています。1964年にバクテリアのグルコース脱水素酵素の補酵素として発見され、1979年にバクテリア由来のメタノール脱水素酵素から単離されて化学構造が決定されました。2003年には理化学研究所の笠原と加藤によってPQQが新規のビタミンである可能性が提唱されました(参考文献1)が、PQQを補酵素として使う酵素がヒトから発見されていないことために、未だにビタミンとしては認められていません。
参考文献1 Kasahara T, Kato T (2003). “Nutritional biochemistry: A new redox-cofactor vitamin for mammals” Nature 422 (6934): 832 - 注2 ドメイン
- タンパク質ドメインとも言われ、他の部分とは個別に進化し機能するタンパク質の部分構造を指します。CcSDHの場合はN末端側から順にヘム鉄を含むドメイン−PQQ依存性糖酸化ドメイン−セルロース結合性ドメインとつながっており、それぞれ電子を受け渡すための機能、糖を酸化する機能、セルロースなどの多糖表面に局在する機能を有していると考えられます。