真核生物の鞭毛モーターの原子レベル部分構造を解明
- 発表者
-
加藤 有介(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任准教授)
(Astbury Centre for Structural Molecular Biology, Institute of Molecular and Cellular Biology, University of Leeds, Research Fellow, 当時)
八木 俊樹(東京大学大学院医学系研究科 分子細胞生物学専攻 講師 当時)
Sarah A. Harris(School of Physics & Astronomy, University of Leeds, Lecturer)
大木 進野(北陸先端科学技術大学院大学 マテリアルサイエンス研究科 教授)
由良 敬(お茶の水女子大学大学院人間文化創成科学研究科 教授)
清水 洋輔(東京大学大学院農学生命科学研究科 応用生命化学専攻 大学院生 当時)
本田 真也(産業技術総合研究所バイオメディカル研究部門 副研究部門長)
神谷 律(東京大学大学院理学系研究科 生物科学専攻 教授 当時)
Stan A. Burgess(Astbury Centre for Structural Molecular Biology, Institute of Molecular and Cellular Biology, University of Leeds, Reader)
田之倉 優(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
発表のポイント
◆真核生物の鞭毛(注1)が運動するために必要な鞭毛ダイニン(注2)と微小管(注3)とが結合する部位の構造とその動的な変化の様子を明らかにした。
◆鞭毛ダイニンに特徴的な突起構造を見いだし、鞭毛ダイニンの微小管への結合は細胞質に存在するダイニンに比べてかなり弱いことが分かった。
◆真核生物の鞭毛運動を駆動させるタンパク質として世界で初めての原子レベル構造の解明であり真核生物が鞭毛を駆動する機構の一端が明らかになった。
発表概要
東京大学大学院農学生命科学研究科の加藤有介特任研究員、田之倉優教授、英国リーズ大学アスブリー構造分子生物学センターのStan Burgess(スタン•バージェス)リーダーらの研究グループは、真核生物の鞭毛(注1)が運動するために必要な分子である鞭毛ダイニンの微小管(注3)との結合部位(MTBD)の立体構造を原子レベルで解明した。
鞭毛ダイニンは真核生物の鞭毛中に規則的に配置されダブレット微小管(注3)上を滑るように行き来することで鞭毛運動を駆動させる。ヒトの鞭毛ダイニンの異常は精子運動の異常を発生させ、男性不妊や細胞運動の異常による内蔵左右逆位の原因になる。
研究グループは今回、鞭毛ダイニンのMTBDは細胞内での物質の輸送に関わっている細胞質ダイニンMTBDには見られない柔軟に可動する突起構造(フラップ)を備えることを明らかにした。さらに驚くべき発見は鞭毛ダイニンMTBDの分子表面の電荷分布が細胞質ダイニンのそれとは大きく異なることであった。
これらの特徴や生化学的解析などにより鞭毛ダイニンの微小管との結合能力と結合機構が細胞質ダイニンと大きく異なることが示唆された。こうした特徴は鞭毛ダイニンが鞭毛中の限られた空間内で他のダイニン分子と協調的に機能する上で非常に重要であると示唆される。本成果は真核生物の鞭毛運動機構の全容解明のために重要な基盤的知見となる。
発表内容
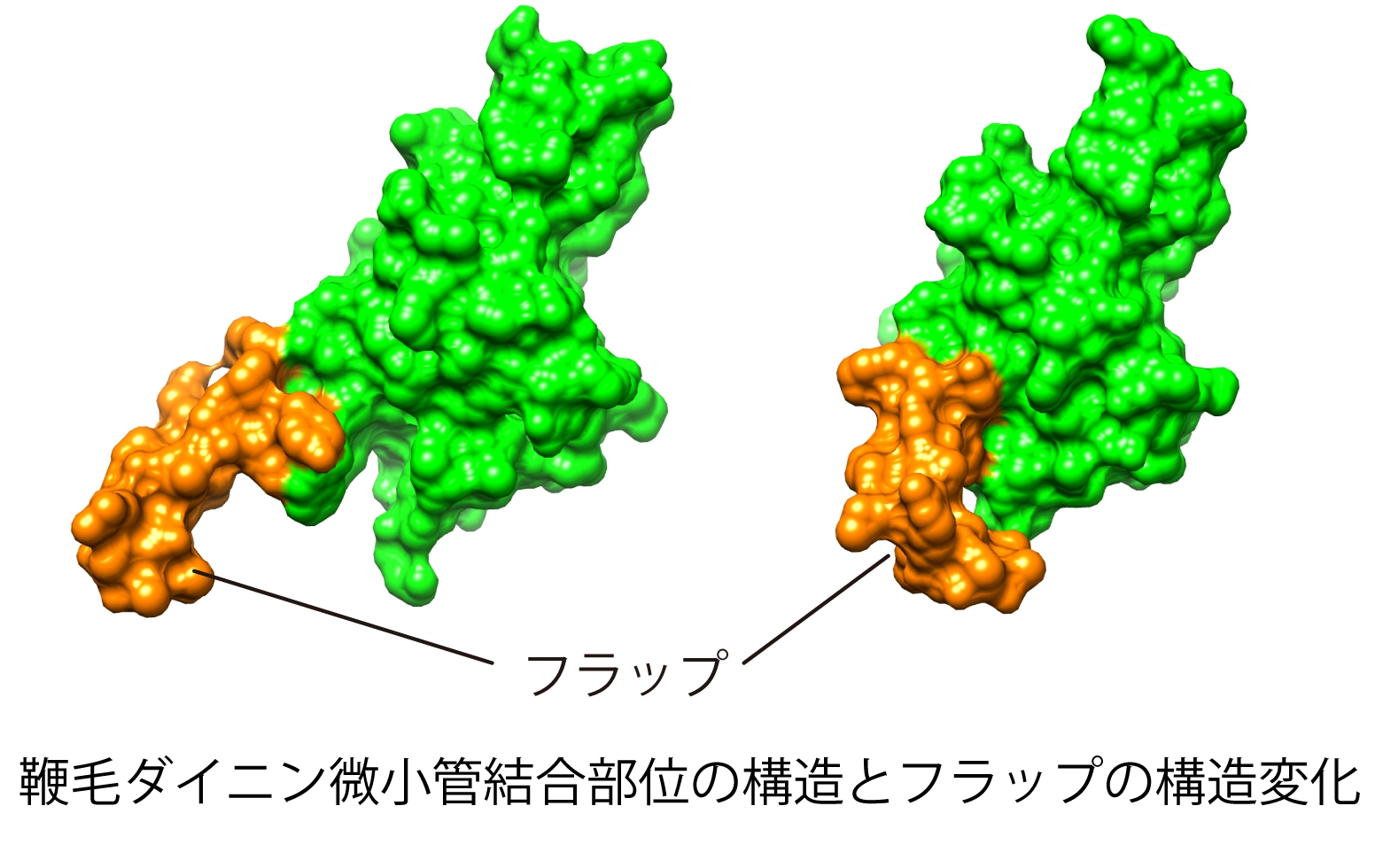
図1 鞭毛ダイニン微小管結合部位の構造とその構造変化では、フラップの構造が伸びた状態と折れ曲がった状態を示す。フラップは鞭毛ダイニンに特徴的な構造である。(拡大画像↗)
図2 鞭毛はさまざまな細胞から毛のように生えた細胞小器官であり細胞の遊泳に必要な推進力を生み出す。特に真核生物の鞭毛としてはクラミドモナスと呼ばれる単細胞生物や精子の鞭毛が代表的である。(拡大画像↗)
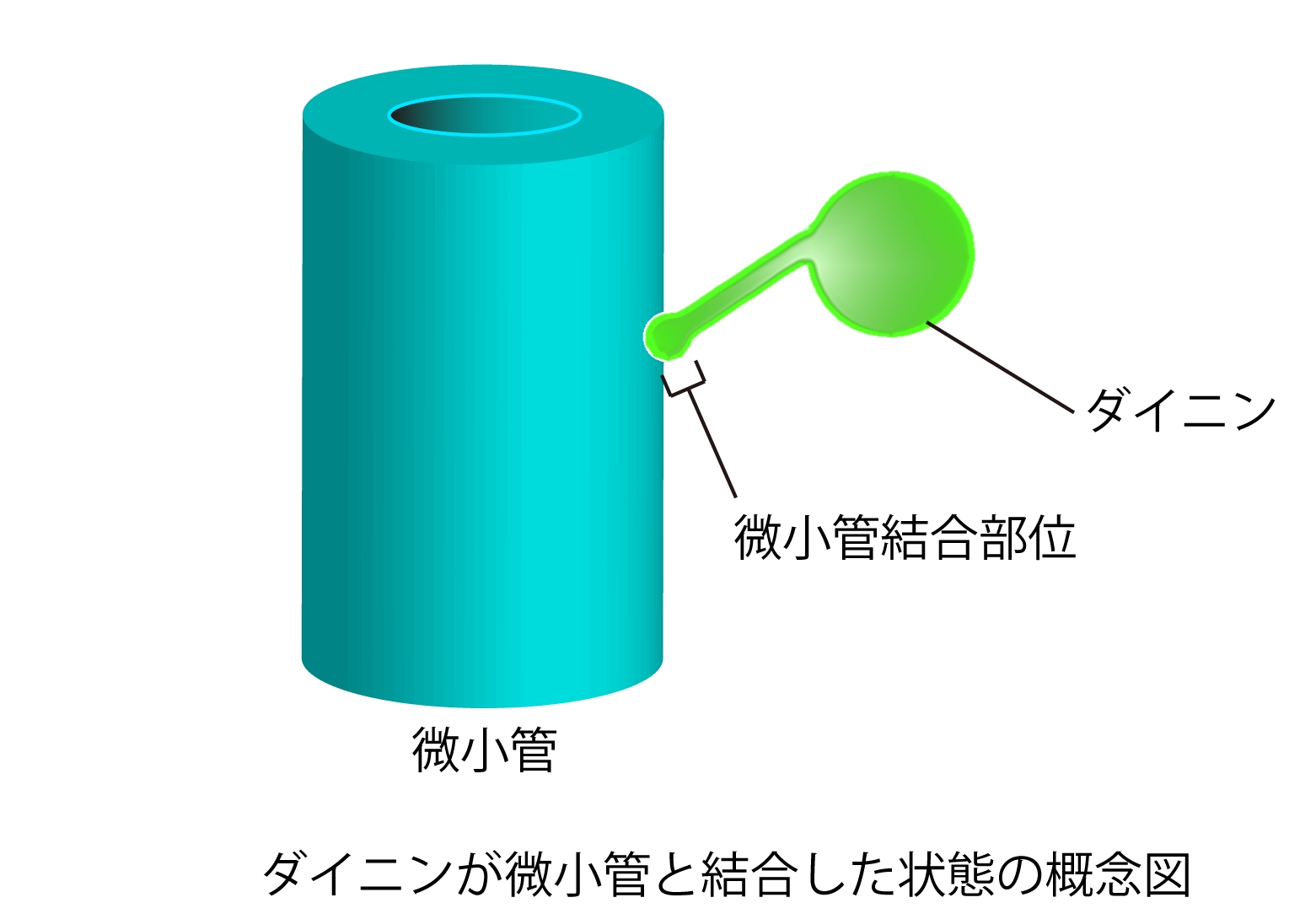
図3 ダイニンは 微小管と呼ばれるタンパク質で出来た管状の繊維の上を滑り運動するタンパク質である。そのうち微小管結合部位はダイニン本体 から細長い構造によって繋がれている。(拡大画像↗)
東京大学大学院農学生命科学研究科の加藤有介特任研究員、田之倉優教授、英国リーズ大学アスブリー構造分子生物学センターのStan Burgess(スタン•バージェス)リーダーらの研究グループは、真核生物の鞭毛が運動するために必要な分子(モーター分子)である鞭毛ダイニンの微小管との結合部位(MTBD)の立体構造を原子レベルで解明した。
ダイニンは微小管上をマイナス端方向へ移動する細胞骨格モーター(注4)であり、真核生物の鞭毛運動や細胞内の物質輸送などを駆動させる。鞭毛中では無数のダイニン分子が規則正しく配置されており、ダイニン分子によって鞭毛のしなやかな湾曲運動が生じる。クラミドモナス(注5)や精子はそうした鞭毛の運動によって水中を自由に運動することができる。鞭毛ダイニンに異常が生じると男性不妊や内蔵逆位等の原因となる。一方で細胞質に存在するダイニン(細胞質ダイニン)は微小管上の小胞輸送などの役割を担う。
ダイニンの分子構造では微小管結合部位とATP加水分解部位(注6)が別々の構造内に存在し、両者の間を細長いストーク構造(注7)がつないでいる。したがってこのストークを介した機能制御機構がダイニンの特筆すべき点である。その機構として提唱されている有力なモデルとしてはストークを形成する2本のα-ヘリックス(注8)同士が滑り合うことで情報が伝達されるというものである。また近年には細胞質ダイニンの微小管結合部位(MTBD)の原子レベルの構造も明らかになっていた。
そこで研究グループはこれまで明らかになっていない真核生物の鞭毛モーターの動作機構の解明を目指し、クラミドモナスの鞭毛内腕に存在するダイニンの一種であるdynein-cのMTBDの溶液中での原子レベルの立体構造を核磁気共鳴(NMR)技術(注9)により明らかにした。その結果、鞭毛ダイニンMTBDの基本構造は細胞質ダイニンMTBDと同様、8本のα-ヘリックスからなることが分かった。ただし、細胞質ダイニンには見られない特徴としてフラップと命名されたβ-シート(注10)からなる突起構造が見られた。また、フラップが柔軟に可動する構造であることも分子動力学計算(注11)などにより明らかにした。
ストークの2本のα-ヘリックスを強制的に平行移動させた状態のdynein-c MTBDを作製し、その微小管との結合能力を調べた。その結果、dynein-c MTBDではストークのα-ヘリックスの平行移動状態を変化させても細胞質ダイニンMTBDで見られたような微小管との結合能力の強弱の変化は見られず、微小管と弱い相互作用しか示さなかった。
dynein-cはなぜ細胞質ダイニンと同様の結合能力を示さないのであろうか。その答えを得るために近年報告された細胞質ダイニンMTBDと微小管の結合状態モデルの細胞質ダイニンMTBDにdynein-c MTBDを置き換えて当てはめた。その結果dynein-cのフラップが微小管表面と接触する可能性があることが判明した。次いで研究グループはdynein-c MTBDの分子表面の電荷分布を細胞質ダイニンのそれと比較した。細胞質ダイニンが微小管と結合する面に相当するα-ヘリックスH1とH3の表面は正電荷が集中していたが、dynein-c MTBDのH1とH3の表面にはそうした電荷の集中は見られなかった。以上のことから、細胞質ダイニンとdynein-cでは微小管との結合能力に差があるだけではなく、微小管との結合機構も異なる可能性が示唆された。
さらにdynein-cが微小管と強い結合を示さなかったことは予想外であった。dynein-cが強い結合を示さなかった理由として、鞭毛ダイニンが存在する環境が鞭毛中という閉鎖された空間であることが関係しているかもしれない。鞭毛ダイニンは鞭毛上に固定されており、ダイニンが移動するレールを提供するダブレット微小管と解離しても離ればなれになることはない。それは、ダブレット微小管もまた鞭毛中で固定されているからである。したがって単一のダイニン分子が微小管に強く結合する必要はない。一方で細胞質ダイニンの場合には単一のダイニン分子が微小管上の長い距離を独立に移動する必要がある。したがって微小管との相互作用が弱いと一度微小管から解離してしまった場合に元の位置に戻って来られなくなる。また鞭毛中では多種かつ多数のダイニン分子が協調することで鞭毛全体としてまとまった運動を生じる必要があるので、個々のダイニン分子と微小管との結合能力が強すぎるとかえって協調性に支障が出る可能性がある。
研究グループの取り組みにより鞭毛ダイニンの部分的な構造と微小管との結合の性質が明らかになった。これにより、その駆動機構に不明点が多い真核生物の鞭毛の運動機構の解明に一歩近づくことができた。また、この成果は鞭毛の巨大分子機構の仕組みを利用した人工機械の構築や男性不妊などの医学的問題の解明に貢献することが予想される。
発表雑誌
- 雑誌名
- 「Structure」
- 論文タイトル
- Structure of the Microtubule-Binding Domain of Flagellar Dynein
- 著者
- Yusuke S. Kato, Toshiki Yagi, Sarah A. Harris, Shin-ya Ohki, Kei Yura, Youské Shimizu, Shinya Honda, Ritsu Kamiya, Stan A. Burgess, and Masaru Tanokura
- DOI番号
- http://dx.doi.org/10.1016/j.str.2014.08.021
- 論文URL
- http://www.cell.com/structure/abstract/S0969-2126%2814%2900288-3
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生物構造学研究室
教授 田之倉 優
特任准教授 加藤 有介
Tel:03-5841-5165
Fax:03-5841-8023
研究室URL:http://fesb.ch.a.u-tokyo.ac.jp//
用語解説
- 注1 鞭毛
- 鞭毛は細胞から生じた細長い構造物であり、細胞内のエネルギー物質を利用することで鞭のようなしなやかな波打ち運動を起こす。たとえば精子は鞭毛の波打ち運動により水中を移動していく。ただしサルモネラ菌や大腸菌などの細菌類の鞭毛と人間など真核生物の細胞が持つ鞭毛では全く構造も駆動原理も異なっている。
- 注2 ダイニン
- 微小管というタンパク質で出来た繊維上を滑り運動するタンパク質の一種で、力を発生して細胞内の構造物の形状を変化させたり物質輸送を行ったりする。
- 注3 ダブレット微小管
- 微小管の基本構造はチューブリンと呼ばれるタンパク質を構成単位として構成される管状構造である。鞭毛中で特徴的に見られるダブレット微小管では、この管が二連になっている。
- 注4 細胞骨格モーター
- 細胞骨格モーターと呼ばれるタンパク質分子には大別してミオシン、キネシン、ダイニンと呼ばれる3種類がある。細胞骨格モーターの共通の性質は生体内のエネルギー物質を利用してタンパク質でできた細長いレールのような構造を滑るようにして移動(滑り運動)していくことである。またその際に力を発生する。たとえば筋肉における力発生は多数のミオシン分子がアクチンフィラメント上を協調的に滑り運動することによる。ダイニンは微小管と呼ばれるフィラメント上を滑り運動することが知られている。
- 注5 クラミドモナス
- 鞭毛を持つ単細胞真核生物の1種で葉緑体をも持つために動物と植物の性質を兼ね備えた性質を示す生物である。和名はコナミドリムシ。
- 注6 ATP
- アデノシン三リン酸のこと。細胞内における主要なエネルギー物質。加水分解される際に非常に大きなエネルギーを発生するため、そのエネルギーがさまざまな細胞活動や酵素等に利用される。
- 注7 ストーク構造
- ダイニンのATP加水分解部位を含む構造単位と微小管結合部位を含む構造単位の間を連結する細長い茎(ストーク)のような形状の構造物。
- 注8 α- ヘリックス
- タンパク質立体構造中によく見られる規則的ならせん構造の1種。
- 注9 核磁気共鳴
- 原子核の磁気的性質を利用して分子の性質を原子レベルで解明することができる技術であり有機低分子化合物やタンパク質、核酸など幅広い物質の構造決定等に利用される。
- 注10 β-シート
- α-ヘリックスと並びタンパク質の構造中によく見られる規則的な構造で、シート状の形状を示す。
- 注11 分子動力学計算
- タンパク質の立体構造は静的なものではなく動的に揺らいでいる。しかしその動きが具体的にどのような動きであるのか立体構造解析の結果だけで判断することは難しい。タンパク質の動的な構造変化の様子を原子レベルで視覚的に理解するためにはタンパク質分のすべての原子核の3次元空間での動きをシミュレーションするする必要があり、そのための主要な手法の1つ。