天然化合物の大環状構造形成における[4+2]-環化付加反応を触媒する酵素の発見
- 発表者
-
橋本 拓哉(東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程2年)
西山 真(東京大学生物生産工学研究センター 教授)
葛山 智久(東京大学生物生産工学研究センター 准教授)
発表のポイント
◆スピロテトロン酸構造を含むポリケタイド化合物の生合成における鍵反応である[4+2]-環化付加反応を触媒する酵素VstJを同定し、その機能を明らかにしました。
◆VstJはわずか142アミノ酸から構成されており、これまでに機能が明らかにされているタンパク質とは相同性を示さない新奇タンパク質でした。
◆VstJによる[4+2]-環化付加反応の触媒機構の解析を進めることで、同様の反応機構を持つ人工酵素の設計が期待できます。
発表概要
スピロテトロン酸構造(注1)を含むポリケタイド化合物(注2)は、放線菌(注3)が生産する二次代謝産物(注4)であり、抗がん活性などのさまざまな有用な生物活性を示すことが知られています(図1)。これまでスピロテトロン酸構造は[4+2]-環化付加反応(注5)によって生合成されるという仮説が提唱されていましたが、実際にはどのような酵素がその反応を担うのかについての知見は全くありませんでした(図2)。
東京大学生物生産工学研究センター、産業総合技術研究所、北里大学、沖縄綜合科学研究所、テキサス大学の共同研究グループは、特徴的なスピロテトロン酸構造を含むポリケタイド化合物、versipelostatin (VST)の生合成を担う遺伝子群を同定しました。さらに、その遺伝子群の中の一つ、vstJ遺伝子から作られるタンパク質(VstJ)が、スピロテトロン酸構造を形成するための鍵酵素であることを明らかにしました。VstJはわずか142アミノ酸から構成される小さなタンパク質ですが、[4+2]-環化付加反応を触媒することでスピロテトロン酸構造を形成し、versipelostatinの大環状構造を完成させることが分かりました(図3)。
今後はVstJのアミノ酸配列情報を用いて、放線菌等のゲノムデータを探索することで、新たなスピロテトロン酸構造を含む未知の天然化合物を効率よく取得できることが期待できます。さらに、VstJによる[4+2]-環化付加反応を触媒する詳細な反応機構を明らかにすることで、多様な[4+2]-環化付加反応を触媒する人工酵素のデザインへの応用が期待されます。
発表内容
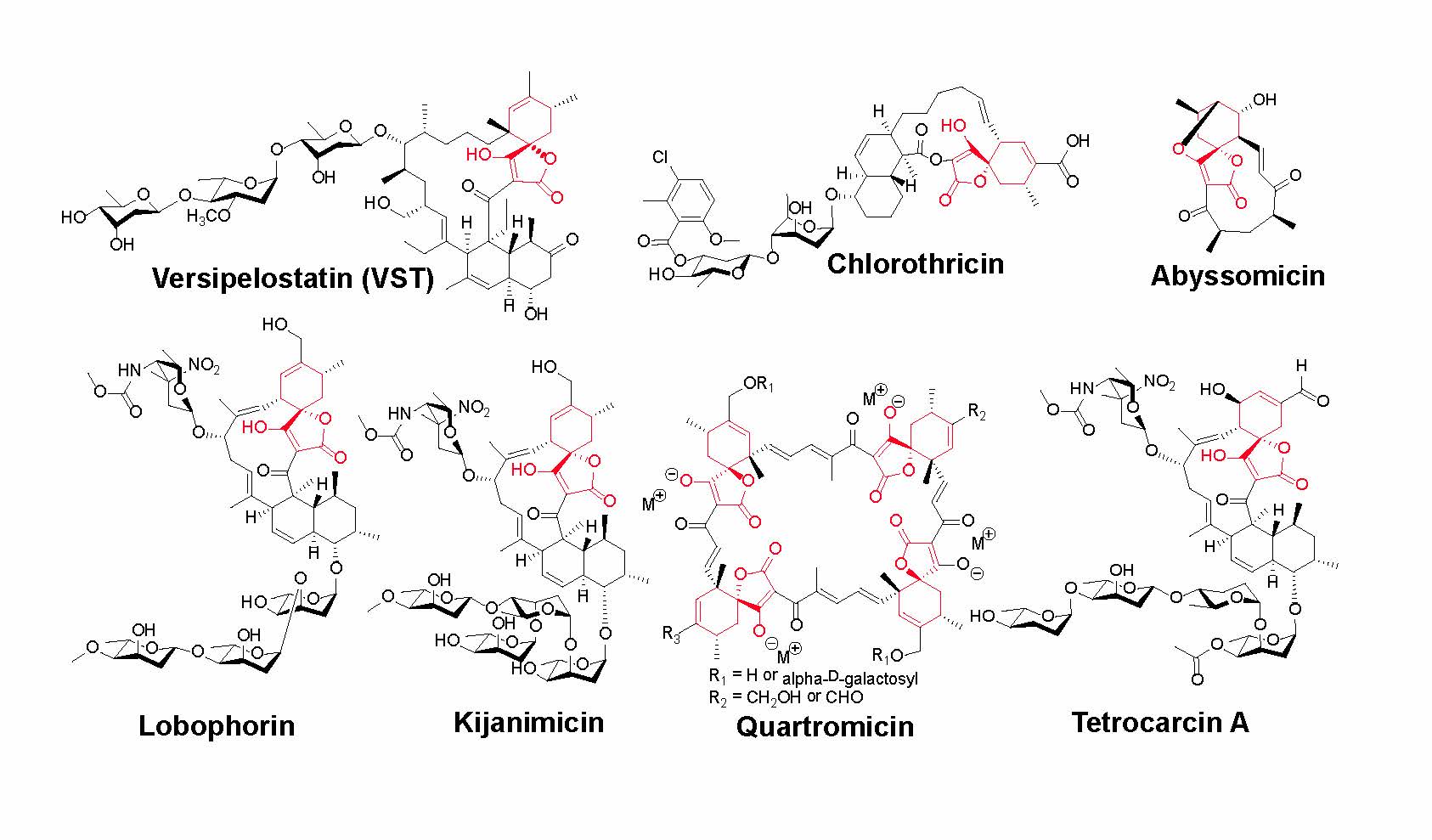
図1 スピロテトロン酸構造(赤色)を含む天然化合物の例(拡大画像↗)
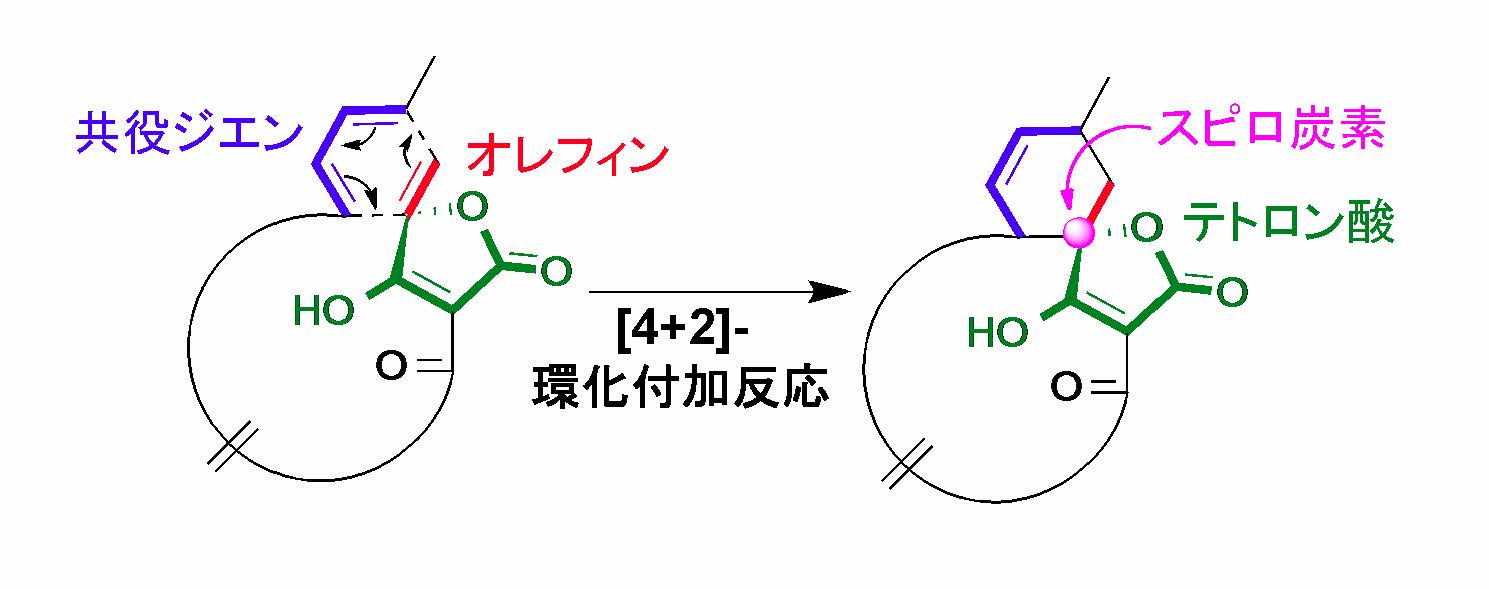
図2 スピロテトロン酸構造(右)の形成において提唱されていた[4+2]-環化付加反応(拡大画像↗)
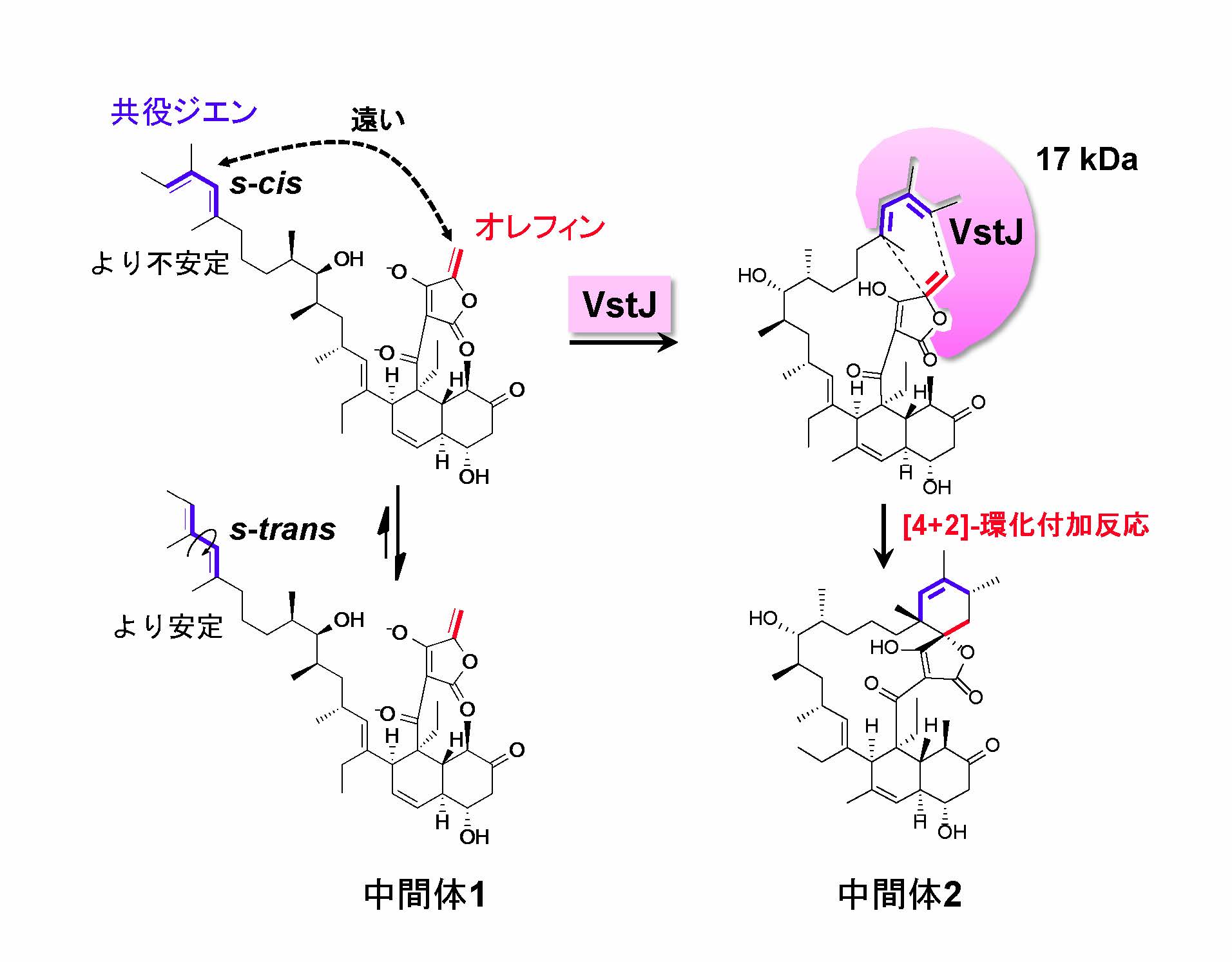
図3 VstJが触媒する[4+2]-環化付加反応とその推定反応機構。VstJの基質である中間体1は、s-transとs-cisの平衡状態で存在しており、VstJが共存しない場合には、共役ジエン(青)とオレフィン(赤)が分子内で遠く離れているためスピロテトロン酸構造を形成することができない。しかし、VstJが存在すると、VstJがより不安定なs-cisとのみ結合し、同時に共役ジエン(青)とオレフィン(赤)を近づけて[4+2]-環化付加反応を加速することで、スピロテトロン酸構造を含む中間体2が生成すると推定している。(拡大画像↗)
土壌細菌である放線菌は抗生物質や抗がん剤、免疫抑制剤などの薬剤またそのリード化合物を生産する微生物として知られています。放線菌はアミノ酸などの比較的構造が単純な一次代謝産物を原料にして代謝を行い、薬剤となりうる複雑な分子骨格を持つ低分子化合物を生産します。スピロテトロン酸構造を持つ天然化合物は、放線菌によって生産されるポリケタイド化合物類の一例であり、抗がん活性などのさまざまな有用な生物活性を示すことが知られています。スピロテトロン酸構造は[4+2]-環化付加反応によって生合成されるという仮説がこれまで提唱されていましたが、どのような酵素によって形成されるのかについての知見はありませんでした。そこでスピロテトロン酸構造を含む天然化合物であるversipelostatin (VST)をモデル化合物として研究を行いました。
まず、VST生合成に関与する遺伝子を特定するため、VSTの生産菌であるStreptomyces versipellis 4083-SVS6株のドラフトゲノムデータを取得し、約100 kbのVST生合成遺伝子群領域を推定しました。次に、その全領域をBACベクター(大腸菌と放線菌の両菌株を宿主にできる人工染色体ベクター)を用いてStreptomyces albusの異種発現系へ導入することでVSTの異種生産に成功しました。これにより100 kbの生合成遺伝子群領域が確かにVSTの生合成に関与していることを証明しました。次に、この異種発現系での遺伝子欠失によって新たに生成したVSTの生合成中間体1を精製して構造を決定しました(図3)。さらに、この中間体1を142アミノ酸から構成される17 kDaの小さなタンパク質VstJと混合して30 ˚Cに保つと、スピロテトロン酸構造が形成されて大環状化しVSTの骨格を有する中間体2が生成することが分かりました(図3)。これらの結果から、VstJが[4+2]-環化付加反応を触媒しスピロテトロン酸構造を形成するVST生合成における鍵酵素であることが明らかになりました。
[4+2]-環化付加反応を触媒する酵素はこれまでに数種が同定されたのみであり、いずれの既知の酵素による[4+2]-環化付加反応も、酵素を添加しない条件でも反応が進行することが知られています。一方、VstJによる[4+2]-環化付加反応は酵素非添加では起こらないことから、VstJは既知の[4+2]-環化付加反応を触媒する酵素とは異なる新しい機構によって反応を触媒していると推定しています。今後、VstJの詳細な触媒機構を明らかにすることで、多様な部分構造を含む基質を受け入れて[4+2]-環化付加反応を触媒する人工酵素の開発への応用が期待できます。
今回の研究成果によって、VstJホモログ(VstJのアミノ酸配列と似ている配列を持つタンパク質)が、他のスピロテトロン酸構造を含むいずれの天然化合物の生合成遺伝子群にも存在することが確認できました。このことは、VstJホモログがスピロテトロン酸構造の形成に共通の鍵酵素であることを示唆しています。したがって、現在公開されているゲノム配列のデータベースを対象にVstJホモログを探索することで、スピロテトロン酸構造を含む新たな天然化合物の発見にも貢献できると考えています。
本研究は、経済産業省からの「次世代型有用天然化合物の生産技術開発」の支援を受けて行われました。
この発表論文はF1000Primeに選ばれています
(http://f1000.com/prime/725315217)。
「F1000Prime」とは、国際的に著名な研究者がその分野において重要な論文を選び、公表していく論文評価システムです。
発表雑誌
- 雑誌名
- 「Journal of the American Chemical Society」
- 論文タイトル
- Biosynthesis of Versipelostatin: Identification of an Enzyme-Catalyzed [4+2]-Cycloaddition Required for Macrocyclization of Spirotetronate-Containing Polyketides
- 著者
- Takuya Hashimoto (橋本拓哉),1 Junko Hashimoto (橋本絢子),2 Kuniko Teruya (照屋邦子),3 Takashi Hirano (平野 隆),3 Kazuo Shin-ya (新家一男),4 Haruo Ikeda (池田治生),5 Hung-wen Liu,6 Makoto Nishiyama (西山 真),1 Tomohisa Kuzuyama (葛山智久)1
1Biotechnology Research Center, The University of Tokyo
2Japan Biological Informatics Consortium
3Okinawa Institute of Advanced Sciences
4National Institute of Advanced Industrial Science and Technology
5Kitasato Institute for Life Sciences, Kitasato University
6Department of Chemistry, University of Texas at Austin, 米国 - DOI番号
- 10.1021/ja510711x
- 論文URL
- http://pubs.acs.org/doi/abs/10.1021/ja510711x
問い合わせ先
東京大学生物生産工学研究センター 細胞機能工学研究部門
准教授 葛山 智久(くずやま ともひさ)
Fax:03-5841-8030
研究室URL:http://park.itc.u-tokyo.ac.jp/biotec-res-ctr/saiboukinou/
用語解説
- 注1 スピロテトロン酸構造
- 図1、図2のようにテトロン酸がスピロ炭素と連なった化学構造。放線菌からスピロテトロン酸構造を持つ多くの天然化合物が単離されている。
- 注2 ポリケタイド化合物
- 主としてアセチルCoA等を出発物質とし、マロニルCoA等のC-2の酢酸単位が縮合して生合成される化合物の総称。ラパマイシンやロバスタチンなどの医薬品として重要な化合物を多数含む。
- 注3 放線菌
- 原核生物の中ではゲノムサイズ、遺伝子数が大きいことが知られており、最も形態分化が進んだとされる菌糸状のバクテリアの仲間。おもに土壌菌として土壌中に生育する。ワクスマンによって放線菌の一種であるStreptomyces griseusから、結核菌に対して抗菌活性を示すストレプトマイシンが発見されて以来、多くの医薬品となる化学物質が放線菌から単離されており、産業上重要な微生物として位置づけられている。
- 注4 二次代謝産物
- アミノ酸や核酸など、生物の生育や生命活動に必須な化合物を一次代謝産物と呼ぶ。これと対照的に、生物の生育や生命活動の維持に必須ではない代謝産物のことを二次代謝産物と呼ぶ。二次代謝産物は生産する生物にとってどのような意義があるのか、その大部分は不明である。植物や真菌、細菌から多くが単離され、生物ごとにユニークな構造を持つ化合物を生産することが知られている。これら二次代謝産物は医薬品などのスクリーニング源として利用されている。
- 注5 [4+2]-環化付加反応
- π電子系を持つ分子同士が付加反応によって環形成する反応を環化付加反応と呼び、π電子系を形成する分子の原子数で[m+n]環化付加反応と表す。そのため、炭素4原子から成る共役ジエンと、炭素2原子からなるオレフィンとの間の環化付加反応は[4+2]-環化付加反応と呼び、Diels-Alder反応が代表例として知られる。