放線菌の酵素による精巧な環化反応メカニズムを解明
- 発表者
-
目黒 亜由子(東京大学大学院農学生命科学研究科 応用生命工学専攻 博士課程3年当時)
本吉 祐大(東京大学大学院農学生命科学研究科 応用生命工学専攻 修士課程2年当時)
寺本 和矢(東京大学大学院農学生命科学研究科 応用生命工学専攻 修士課程2年)
金 承榮(東京大学大学院農学生命科学研究科 応用生命工学専攻 博士課程3年当時)
富田 武郎(東京大学生物生産工学研究センター 助教)
西山 真(東京大学生物生産工学研究センター 教授)
葛山 智久(東京大学生物生産工学研究センター 准教授)
発表のポイント
◆5員環−8員環−5員環が縮合したテルペン骨格の生合成における鍵反応を触媒するテルペン環化酵素CotB2の反応機構の詳細を、明らかにしました。
◆CotB2は、3回の遠距離のヒドリド転位と1回の炭素−炭素結合の組換えを伴い、立体配置を精密に制御しながら3環性の炭素骨格を正確に組み立てることが分かりました。
◆他のテルペン環化酵素についてもCotB2と同様に反応機構の解析を進めることで、生物活性を示す多様な化合物を創製するための新しい生体触媒の開発が期待できます。
発表概要
cyclooctatin(図1)は、放線菌(注1)に分類されるStreptomyces melanosporofaciens MI614-43F2株が生産するテルペン化合物(注2)の一種です。これまでに、cyclooctatinの骨格は、テルペン環化酵素CotB2が直鎖状基質であるgeranylgeranyl diphosphate (GGDP)に作用して環化と水酸化を触媒し、3つの環構造と6個のキラル中心(注3)を含むcyclooctat-9-en-7-olに変換することで構築されると推定されてきました(図1)。しかしながら、基質と反応産物との間で構造が大きく変化する環化反応をCotB2がどのような仕組みで触媒するのかの詳細については、これまで明らかにされてはいませんでした。
東京大学生物生産工学研究センター、大阪市立大学、微生物化学研究所の共同研究グループは、トレーサー実験(注4)と試験管内での酵素反応とを組み合わせて解析することで、CotB2の反応機構の詳細を解明することに成功しました。
テルペン環化酵素の同定例は増えつつあるものの、その反応機構を詳細に解析した例はまだ多くはありません。今後は、他のテルペン環化酵素についても詳細な反応機構の解析を進めることで、生物活性を示す多様な化合物を創製するための新しい生体触媒の開発が期待できます。
発表内容
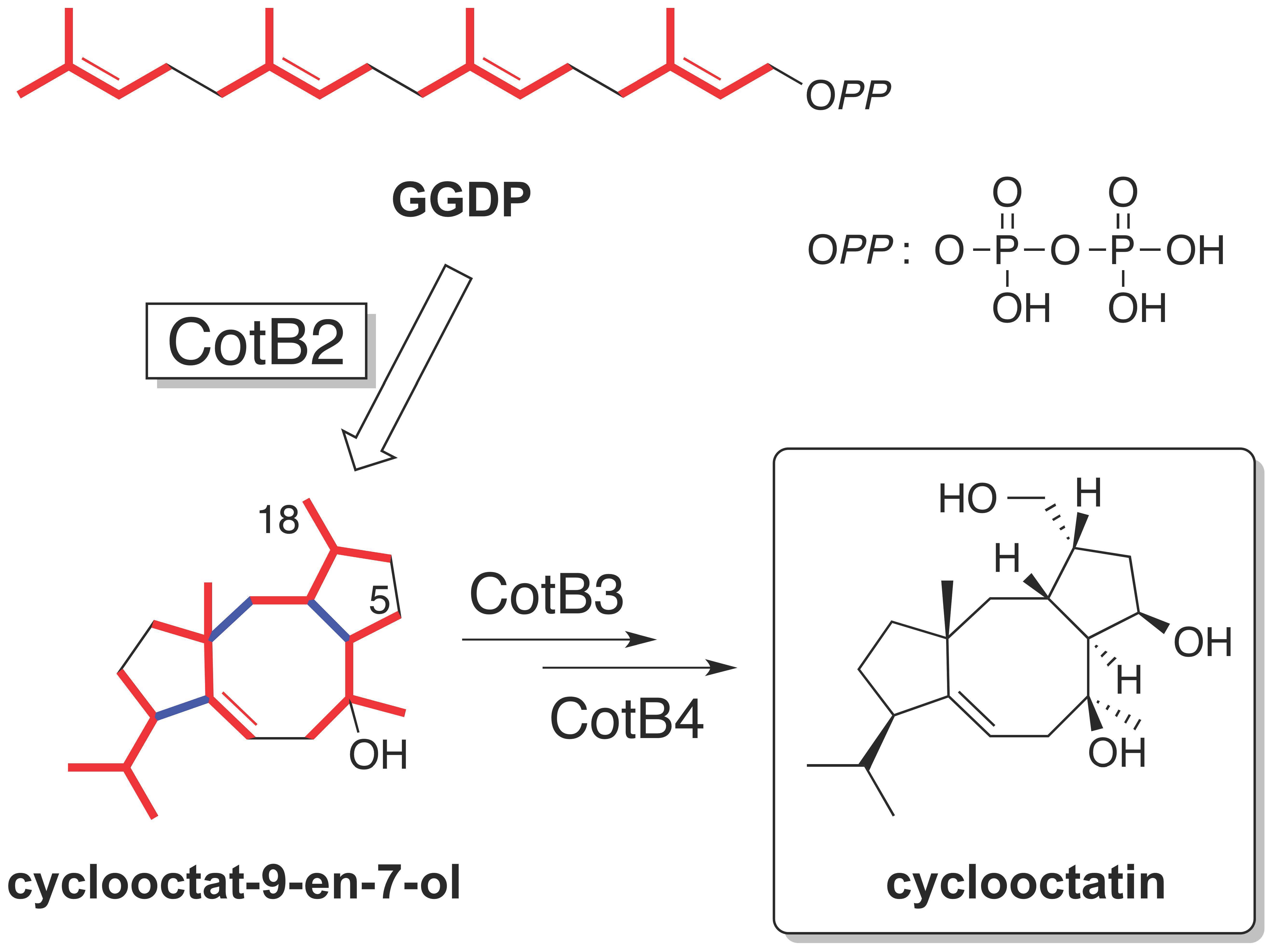
図1 cyclooctatinの構造とその推定生合成経路。テルペン環化酵素CotB2がGGDPに作用して、cyclooctat-9-en-7-olが生成し、その後、CotB3とCotB4がそれぞれ水酸化を触媒することでcyclooctatinが完成する。CotB2の基質のGGDPにはキラル中心はないが、反応産物のcyclooctat-9-en-7-olには6個のキラル中心がある。炭素5個からなるイソプレン単位を赤い太線で示した。GGDP、cyclooctat-9-en-7-ol、cyclooctatinは、このイソプレン単位を4つ含んでいる。青い太線はCotB2の作用で新たに生成する炭素−炭素間の3つの共有結合。(拡大画像↗)
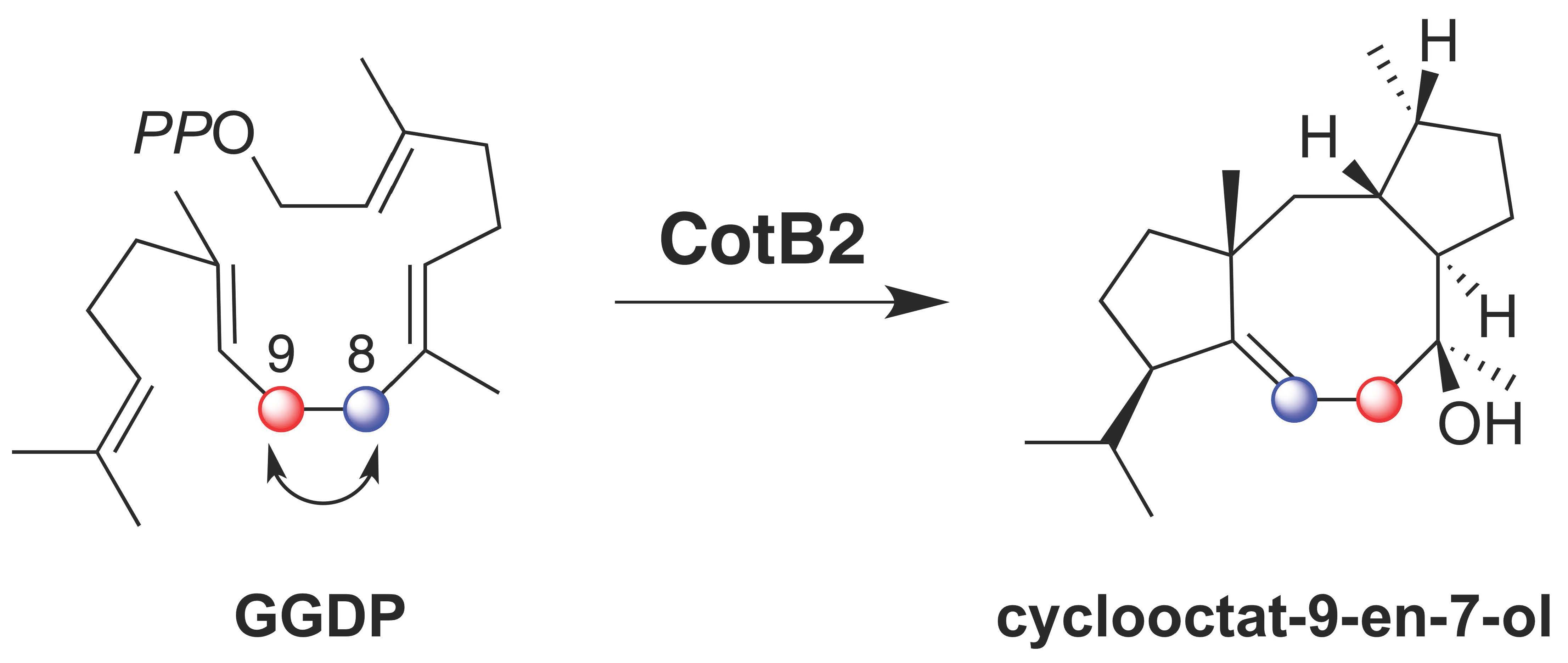
図2 CotB2の触媒する環化反応の過程でGGDPの8位の炭素と9位の炭素が入れ換わりcyclooctat-9-en-7-olが合成される。(拡大画像↗)
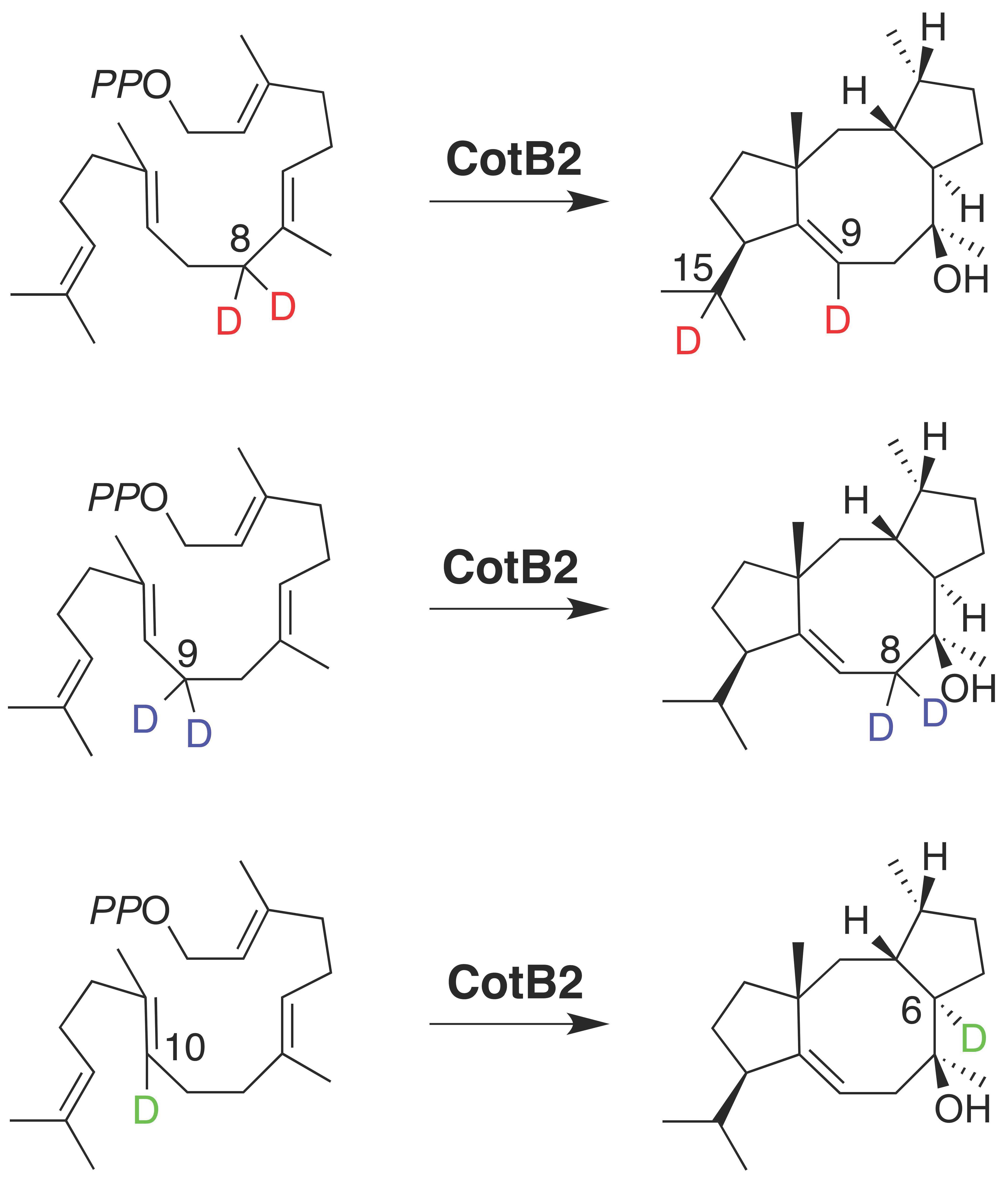
図3 位置特異的に重水素標識したGGDPとCotB2との反応。GGDPの8位の2つの重水素(赤色)はcyclooctat-9-en-7-olの9位と15位に、9位の2つの重水素(青色)は2つとも8位に、10位の重水素(緑色)は6位に、それぞれ転位する。(拡大画像↗)
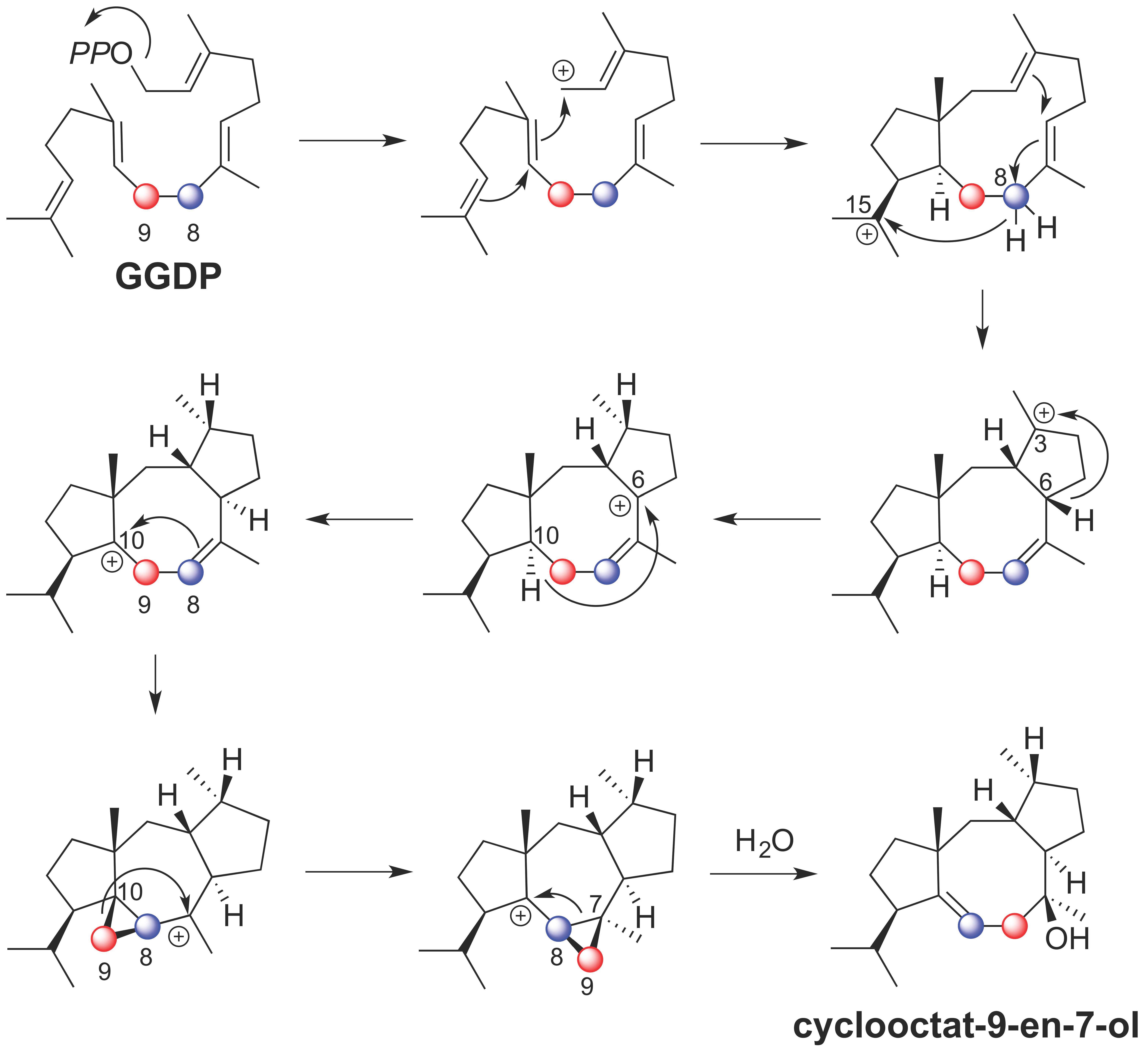
図4 CotB2の反応機構。CotB2はGGDPに作用して、3回の遠距離ヒドリド転位と1回の炭素−炭素結合の組換えを伴いcyclooctat-9-en-7-olを生成する。(拡大画像↗)
cyclooctatinは、放線菌の一種Streptomyces melanosporofaciens MI614-43F2株が生産する炭素数20個からなるテルペン化合物であり、原核生物から初めて単離された5-8-5員環構造を有しています(図1)。このテルペン化合物は、lysophospolipidの脂肪酸エステル結合を加水分解するlysophospholipaseを阻害することで、抗炎症活性を示すことが知られています。これまでに、cyclooctatinはCotB1からCotB4の4つの酵素で生合成されること、CotB1がGGDPを合成し、CotB2がGGDPの環化と水酸化を触媒して5-8-5員環を持つcyclooctat-9-en-7-olを生成、次いで水酸化酵素であるCotB3とCotB4がそれぞれ炭素5位と炭素18位に水酸基を付加して、最終的にcyclooctatinを合成することが明らかにされていました。中でも、CotB2は、一つの生合成酵素の触媒作用でキラル中心を持たない直鎖状の基質GGDPから5-8-5員環骨格に6個のキラル中心を含むcyclooctat-9-en-7-olを一気に構築するユニークな酵素であり、どのような仕組みで立体配置を精密に制御しながら環状構造を作り上げるのか、その詳細な環化反応機構に興味が持たれていました(図1)。
今回、研究グループは、6個すべての炭素原子を炭素13で標識した安定同位体グルコースを用いたトレーサー実験と、位置特異的に水素原子を重水素原子に置換したGGDPを使った酵素反応とを組み合わせて、CotB2が触媒する環化反応を詳細に解析しました。その結果、トレーサー実験では、核磁気共鳴分光法(分子の構造を調べる分析方法)によって、CotB2の触媒作用の過程でGGDPの8位の炭素と9位の炭素が入れ換わることが分かりました(図2)。そこで、次に、8位、9位、10位のそれぞれの水素原子を重水素原子に置換したGGDPを化学合成し、これらの位置特異的重水素化GGDPとCotB2とを反応させて、それぞれの反応産物のどの位置に重水素が転位するのかを核磁気共鳴分光法によって解析しました。その結果、1)GGDPの8位の2つの重水素はcyclooctat-9-en-7-olの9位と15位に、2)9位の2つの重水素は2つとも8位に、3)10位の重水素は6位に、それぞれ転位していることが分かりました(図3)。最終的に、これらの実験結果を統合してCotB2の反応機構を考えたところ、図4に示す反応機構を導きだすことが出来ました。CotB2は、基質であるGGDPに対して作用し、末端のジリン酸基の解離によって反応を開始して、求電子的閉環反応や、8位から15位へのヒドリド転位、6位から3位へのヒドリド転位、10位から6位へのヒドリド転位の後、シクロプロパン環の形成と開環によって炭素−炭素結合の組換えを行い、立体配置を精密に制御しながら5-8-5員環骨格を組み立てることが分かりました。
放線菌は構造多様な天然化合物を生産することのできる微生物であり、おそらく進化の過程でCotB2のような巧みな触媒能を伴ったテルペン環化酵素を獲得してきたと考えています。今後は、CotB2の結晶構造を明らかにして、その構造を基にCotB2を構成する重要なアミノ酸残基を特定し、その一部を他のアミノ酸に置換することで新しい骨格を持つテルペンを合成可能な人工酵素を作製する予定です。また、他のテルペン環化酵素についても詳細な反応機構の解析を進めることで、生物活性を示す多様な化合物を創製するための新しい生体触媒の開発が期待できると考えています。
この研究は、日本学術振興会からの「最先端・次世代研究開発支援プログラム」と「科学研究費補助金」、および文部科学省からの科学研究費補助金(新学術領域研究「天然物ケミカルバイオロジー」)の支援を受けて行われました。
発表雑誌
- 雑誌名
- 「Angewandte Chemie International Edition」
- 論文タイトル
- An Unusual Terpene Cyclization Mechanism Involving a Carbon−Carbon Bond Rearrangement
- 著者
- Ayuko Meguro,[a] Yudai Motoyoshi,[a] Kazuya Teramoto,[a] Shota Ueda,[b] Yusuke Totsuka,[b] Yumi Ando,[b] Takeo Tomita,[a] Seung-Young Kim,[a] Tomoyuki Kimura,[c] Masayuki Igarashi,[c] Ryuichi Sawa,[c] Tetsuro Shinada,[b] Makoto Nishiyama,[a] Tomohisa Kuzuyama[a]
a Biotechnology Research Center, The University of Tokyo
b Graduate School of Science, Osaka City University
c Institute of Microbial Chemistry, Tokyo - DOI番号
- 10.1002/anie.201411923
- 論文URL
- http://onlinelibrary.wiley.com/doi/10.1002/anie.201411923/full
問い合わせ先
東京大学生物生産工学研究センター 細胞機能工学研究部門
准教授 葛山 智久(くずやま ともひさ)
Tel:03-5841-3073
Fax:03-5841-8030
研究室URL:http://park.itc.u-tokyo.ac.jp/biotec-res-ctr/saiboukinou/
用語解説
- 注1 テルペン化合物
- 炭素5個からなるイソプレンとよばれる化学構造を構成単位とする一群の天然化合物の総称。カロテノイド(色素、抗酸化作用)、タキソール(抗癌作用)、アルテミシニン(抗マラリア作用)などが知られている。コエンザイムQ10も、その構造の一部に、イソプレン構造をもっている。
- 注2 放線菌
- 原核生物の中ではゲノムサイズ、遺伝子数が大きいことが知られており、最も形態分化が進んだとされる菌糸状のバクテリアの門。おもに土壌菌として土壌中に生育する。ワクスマンによって放線菌の一種であるStreptomyces griseusから、結核菌に対して抗菌活性を示すストレプトマイシンが発見されて以来、約2,400種の抗生物質のうち、約2,000種が放線菌によって生産されることが報告されている。多くの医薬品となる化学物質が放線菌から単離されており、産業上重要な微生物として位置づけられている。
- 注3 キラル中心
- 分子のキラリティー(ある分子が、その鏡像と重ね合わすことができない性質)を生じさせる元となる原子のこと。キラル中心は、目的の生物活性を示すために重要な因子である。また、キラル中心を精密に制御しながら化学合成を行うことは、困難を伴うことが多い。一方で、酵素反応では、キラル中心は厳密に制御される。
- 注4 トレーサー実験
- 同位体を利用した実験方法で、特定の部位を同位体で標識した化合物を生物に投与し、同位体の存在を目印に、特定物質の代謝や合成経路を調べる実験方法。
- 注5 ヒドリド転位
- 反応の途中でヒドリドイオン(= 水素化物イオン = H−)が転位すること。