2型糖尿病の原因の一つであるインスリン抵抗性発症機構の一部を解明
- 発表者
-
安藤 康年(東京大学大学院農学生命科学研究科 応用動物科学専攻 博士課程3年生;当時)
篠澤 裕介(東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程2年生;当時)
飯島 由実(東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程2年生;当時)
Bu-Chin Yu (東京大学大学院農学生命科学研究科 応用動物科学専攻 ポスドク)
曽根 芽里(東京大学大学院農学生命科学研究科 応用動物科学専攻 研究員)
大井 優子(東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程2年生;当時)
綿中 優介(東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程2年生;当時)
千田 和広(東京大学大学院農学生命科学研究科 応用動物科学専攻 教授)
伯野 史彦(東京大学大学院農学生命科学研究科 応用動物科学専攻 助教)
高橋 伸一郎(東京大学大学院農学生命科学研究科 応用動物科学専攻 准教授)
発表のポイント
◆2型糖尿病の原因の一つであることが知られているインスリン抵抗性(注1)発症に、GKAP42という新規タンパク質が関与していることを発見しました。
◆インスリン抵抗性が発症する過程で、「GKAP42が分解されることによりインスリンシグナルが維持できなくなる」という新しい機構が存在していることを示しました。
◆GKAP42は、cGK-Iαという酵素が活性化されることで分解されることもわかりました。cGK-Iαの阻害剤はインスリン抵抗性を解除する新たな抗糖尿病薬の候補として期待されます。
発表概要
インスリンは、糖代謝制御に重要な役割を果たしているホルモンです。しかし、肥満などによって脂肪組織からサイトカインの一つであるTNF-αが産生されると、インスリン抵抗性を発症し糖利用が低下、その結果、糖尿病が発症することが知られています。しかし、インスリン抵抗性の発症メカニズムの詳細は未だ不明な部分が多く、その解明は急務です。
東京大学大学院農学生命科学研究科の伯野史彦助教らの研究グループは、インスリンシグナルを調節する重要な因子として、GKAP42を見出しました。この分子は、インスリンの細胞内シグナル伝達に重要な役割をはたしているインスリン受容体基質(IRS)(注2)と相互作用し、インスリンシグナルを正常に維持していることを明らかにしました。さらに、TNF-αによって誘導されるインスリン抵抗性は、GKAP42のタンパク質が減少することで引き起こされることがわかりました。これらの成果は、インスリン抵抗性の発症機構に新しい観点を提供するとともに、全く新しい作用点を有する抗糖尿病薬の開発などに利用されることが期待されます。
発表内容
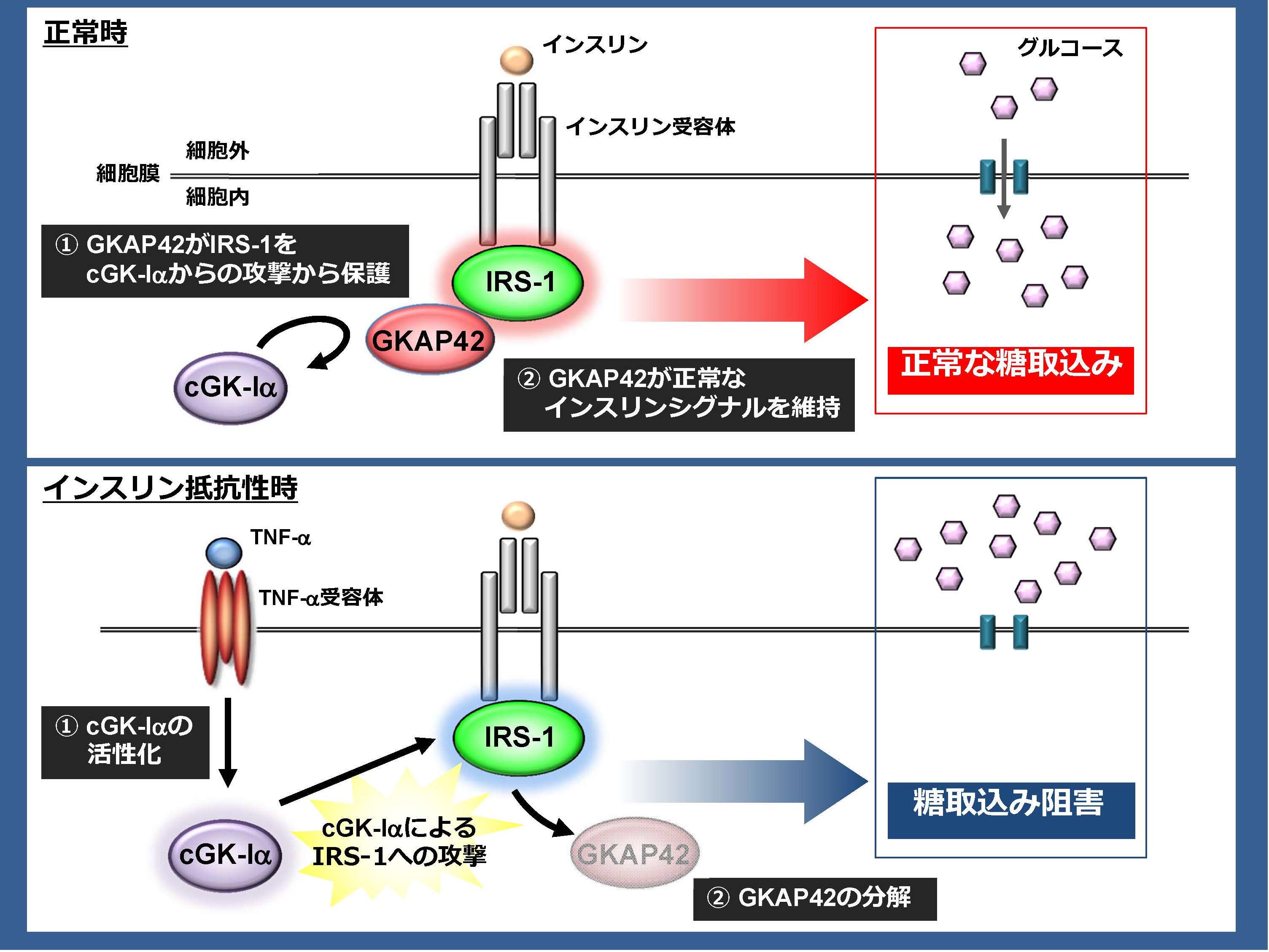
図1 正常時においては、GKAP42がIRS-1をcGK-Iαによる攻撃から保護しているため、正常なインスリンシグナルが維持され、糖取り込みも正常に起こる。ところが、TNF-a処理などによってcGK-Iαが活性化されると、cGK-IαはGKAP42を分解してしまい、直接IRS-1を攻撃する。この攻撃によってIRS-1を介したインスリンシグナルが抑制され、糖取り込みが阻害されてしまう。(拡大画像↗)
インスリンは、糖代謝制御に重要な役割を果たしているホルモンです。膵臓β細胞からインスリンが分泌されると、筋肉や脂肪組織に働きかけ、血中の糖を細胞内に取り込ませることによって血糖値を調節しています。しかし、肥満などによって脂肪組織からアディポカイン(注3)と呼ばれるサイトカイン(TNF-αなど)が産生されると、血中に十分量のインスリンが存在するにもかかわらず、インスリンが正常に働かなくなるインスリン抵抗性が発症、糖利用が低下し、2型糖尿病を発症することが知られています。これまでの研究によって、インスリン抵抗性を発症した脂肪細胞では、インスリンのシグナルを細胞内に伝達するために重要な役割を果たしているインスリン受容体基質-1(IRS-1)が正しく機能しないことがわかっています。しかし、IRS-1を介した機能が阻害される詳細な機構は未だ不明な点が多く、インスリン抵抗性の発症メカニズムの解明は急務です。
東京大学大学院農学生命科学研究科伯野史彦助教らの研究グループは、IRS-1と相互作用する分子としてGKAP42を同定しました。そして、同定したGKAP42のインスリンシグナル伝達や生理活性発現に果たす役割を検討すると共に、インスリン抵抗性発症への関与を明らかにすることを目的に研究を進めました。まず、GKAP42のインスリンシグナルの活性化およびインスリン生理活性発現における役割を解析するために、脂肪細胞の内在性GKAP42をsiRNA(注4)法により発現抑制し、IRS-1を介したインスリンシグナル及び糖取込みを検討しました。その結果、GKAP42の発現抑制によってIRSを介したインスリンシグナルが抑制され、同時に糖の取込みも阻害されました。つまり、GKAP42はインスリンシグナルを維持する機能を有し、正常な糖取り込みに必要な分子であることがわかりました。一方で、アディポカインであるTNF-αの刺激を受けると、GKAP42のタンパク量が減少したことから、インスリン抵抗性を発症した脂肪細胞では、GKAP42のタンパク量が減少するためインスリン抵抗性を発症していることが明らかとなりました。GKAP42はcGMP-dependent kinase (cGK)-Iαと相互作用していることが知られているので、次にcGK-αIがTNF-α刺激によるGKAP42のタンパク量の減少に関与するかを調べました。脂肪細胞の内在性cGK-Iαを発現抑制するとTNF-αで誘導されるGKAP42タンパク量の減少が回復し、同時にTNF-αで誘導されるインスリン抵抗性も解除されました。さらに、TNF-α刺激によってインスリン抵抗性を発症した脂肪細胞内では、cGK-Iαの活性が増加することから「TNF-αはcGK-Iαを活性化し、この活性の増加はGKAP42の分解を促進する。これによりIRS-1を介したインスリンシグナル伝達が抑制され糖取り込みが阻害、その結果、インスリン抵抗性が発症する」という全く新しい機構の存在を示すことができました。
今回の成果は、インスリン抵抗性の発症機構に、これまでにない全く新しい観点を提供するものです。また、cGK-Iαのタンパク質を減少させることによって、インスリン抵抗性が解除されたことから、cGK-IαやGKAP42は抗糖尿病薬開発の標的分子として利用されることが期待されます。
発表雑誌
- 雑誌名
- 「The Journal of Biological Chemistry, Vol. 290, Issue 9, 5881-5892, February 27, 2015」
- 論文タイトル
- Tumor Necrosis Factor (TNF)-α-induced Repression of GKAP42 Protein Levels through cGMP-dependent Kinase (cGK)-Iα Causes Insulin Resistance in 3T3-L1 Adipocytes
- 著者
- Yasutoshi Ando; Yusuke Shinozawa; Yumi Iijima; Bu-Chin Yu; Meri Sone; Yuko Ooi; Yusuke Watanaka; Kazuhiro Chida; Fumihiko Hakuno; Shin-Ichiro Takahashi
- DOI番号
- 10.1074/jbc.M114.624759
- 論文URL
- http://www.jbc.org/content/early/2015/01/13/jbc.M114.624759.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 応用動物科学専攻 動物細胞制御学研究室
助教 伯野 史彦
Tel:03-5841-1310
Fax:03-5841-1311
研究室URL:http://endo.ar.a.u-tokyo.ac.jp/
用語解説
- 注1 インスリン抵抗性
- 血中に十分量のインスリンが存在するにも関わらず、標的細胞においてインスリンが正常にはたらなくなった状態のことです。通常、食事などで血糖値が高くなると膵臓からインスリンが分泌されますが、インスリン抵抗性の状態ではインスリンの感受性が低下しているため、標的組織において糖を取り込まないため血糖値が下がりません。2型糖尿病発症の原因の一つはインスリン抵抗性であると考えられています。
- 注2 インスリン受容体基質 (IRS)
- インスリンが細胞膜上の受容体で受け取られた後、細胞内ではインスリン受容体基質 (IRS) を介したシグナルが伝達され糖が取り込まれます。何らかの作用によってIRSを介したシグナル伝達が抑制されると糖取込みが阻害されます。
- 注3 アディポカイン
- 肥大した脂肪細胞から分泌される生理活性物質の総称です。
- 注4 siRNA (small interfering RNA)
- 21-23塩基対から成る低分子二本鎖RNAの事を示します。siRNAの配列によって配列特異的に転写を抑制し遺伝子の発現を抑制します。