機能性食品成分ケルセチンによる代謝改善効果の新たな分子機構を解明
- 発表者
-
清水 誠(東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学研究室 助教)
李 娟(東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学研究室 博士課程(当時))
井上 順(東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学研究室 准教授)
佐藤 隆一郎(東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学研究室 教授)
発表のポイント
◆食品成分ケルセチンが、小腸細胞でのリポタンパク質(注1)代謝の遺伝子発現を制御することを初めて明らかにしました。また、その分子制御機構はケルセチンが転写因子に結合するという興味深いメカニズムであることを明らかにしました。
◆食品成分ケルセチンがリポタンパク質代謝関連遺伝子の発現を制御すること、そしてケルセチンの転写因子への結合を介した生理活性機構を初めて明らかにしました。
◆我々が日常的に野菜類などから摂取するポリフェノール類の中で、最も量の多い成分の一つと考えられているケルセチンの小腸での新たな分子機構を明らかにしたことにより、機能性食品成分としてケルセチンの有効利用が益々盛んになることが期待されます。
発表概要
東京大学大学院農学生命科学研究科 佐藤隆一郎教授らの研究グループは、食品成分によるリポタンパク質代謝制御の新たな分子機構を明らかにしました。
肥満や糖尿病をはじめとする生活習慣病の予防、改善には、脂質の摂取コントロール及び脂質代謝の改善が重要です。食事由来の脂質は小腸で吸収された後、カイロミクロンと呼ばれるリポタンパク質として肝臓に運搬されます(図1)。リポタンパク質合成の際に、ミクロソームトリアシルグリセロール輸送タンパク質(MTP)やアポリポタンパク質B(アポB)(注2)は重要なタンパク質として機能しています。特にアポBは様々な転写因子により遺伝子発現調節を受けることが知られています。MTPの阻害剤や遺伝子欠損マウスの解析より、小腸でのカイロミクロン合成抑制は脂質代謝の改善に繋がることが報告されています。そこでこれら遺伝子の発現を負に制御する食品成分を探索したところ、ケルセチンに強い抑制効果を見出しました。
玉ねぎなどに豊富に含まれるフラボノイドの1種であるケルセチンは、これまで脂肪肝改善、脂質代謝改善効果を発揮することが報告されていました。しかし、ケルセチンの直接の標的因子など分子レベルでの作用機序は殆ど分かっていませんでした。
本研究では、ケルセチンが小腸のリポタンパク質代謝関連遺伝子、特にアポB遺伝子の発現を低下させることを見出しました。更にケルセチンがアポB遺伝子の発現を制御する転写因子C/EBPβ(注3)に結合し、その活性を抑制することを明らかにしました。
発表内容
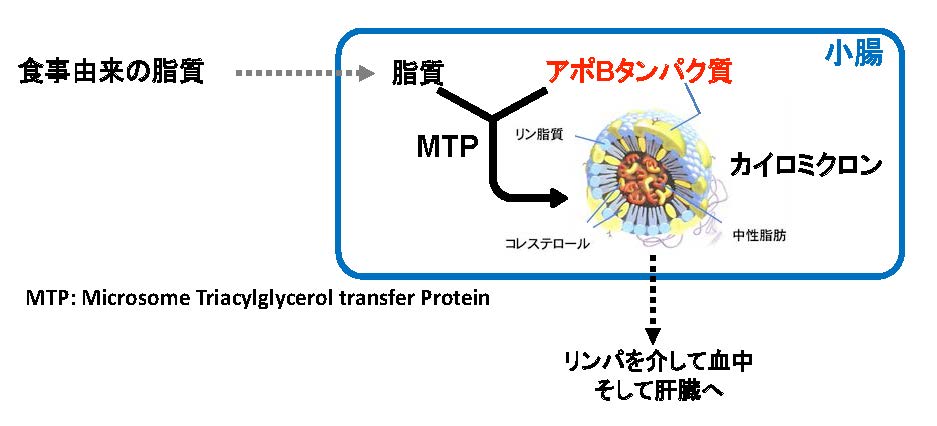
図1 小腸におけるカイロミクロン合成・分泌
食事由来の脂質は小腸で吸収された後に、MTPの働きでリン脂質、アポBで囲まれたカイロミクロンを形成し、リンパへと分泌される。(拡大画像↗)
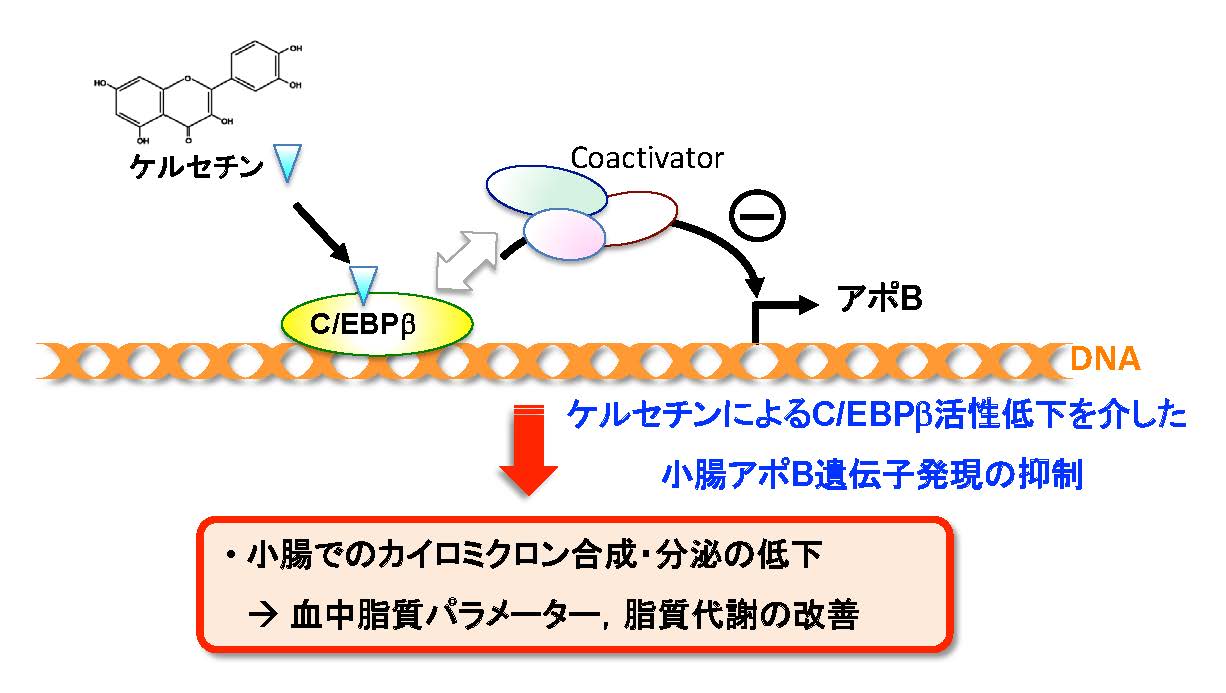
図2 ケルセチンによる小腸アポB遺伝子の発現抑制の概略とその意義
本論文においてケルセチン結合ビーズを用い、転写因子C/EBPβがケルセチンと結合することを明らかにした。この結合によりC/EBPβのDNA結合能に変化はなく、アポB遺伝子発現の減少が認められた。カイロミクロン合成・分泌抑制は、血中脂質パラメーターの改善を介して脂質代謝を良好な方向へと導くことが期待される。(拡大画像↗)
肥満や糖尿病をはじめとする生活習慣病の蔓延は、先進国を中心とした深刻な問題となっており、その予防対策が喫緊の課題となっています。特に脂質代謝の改善は生活習慣病予防に重要ですが、次第に欧米化する日本人の食生活において脂質摂取のコントロールは必ずしも容易ではなく、機能性食品成分の有効利用が注目されています。
ケルセチンは玉ねぎなどに含まれるポリフェノール類の一つです。これまで抗酸化、抗脂肪肝効果など様々な生理活性が報告されています。一方、ケルセチンがどのようなメカニズムでこれらの効果を発揮するかは十分に解明されていませんでした。
我々は、食事由来成分の吸収される部位、小腸でのケルセチンの標的因子に注目しました。食品成分が脂肪組織などで作用する場合、腸管から吸収されたのちに血流に乗り標的組織へ到達する過程で、成分の濃度を高く維持することは困難を伴います。一方、小腸では食品成分自身が吸収されたのちに一時的に高濃度で存在し得るため、食事成分の機能が発揮されやすい組織と考えたためです。
ヒト小腸上皮様細胞であるCaco-2細胞にケルセチンを24時間処理し、mRNAを回収して様々な遺伝子発現を解析しました。その結果、アポBなどの複数のリポタンパク質代謝関連遺伝子のmRNA量がケルセチンにより有意に低下していることを見出しました。特に発現抑制が顕著だったアポB遺伝子に注目し、その遺伝子発現調節領域の解析を行いました。その結果、アポB遺伝子のプロモーター上に存在する転写因子C/EBPβの結合部位がケルセチンの作用に重要であることが分かりました。次にその作用機序の解析の結果、ケルセチンはC/EBPβの発現やDNA結合能ではなく、転写活性そのものを抑制することが分かりました。さらに、ケルセチンを共有結合したアガロースビーズ(理化学研究所・長田裕之先生、齋藤臣雄先生より御供与)を用いた実験の結果、ケルセチンがC/EBPβに結合することが分かりました。このことから、リポタンパク質代謝制御におけるケルセチンの直接の標的因子はC/EBPβであることが明らかとなりました。C/EBPβはアポB以外のリポタンパク質代謝関連の遺伝子発現にも関与していることが知られていることから、ケルセチンはリポタンパク質代謝の重要な制御因子を調節する機能を持つと考えられます。
以上の結果から、小腸細胞におけるケルセチン→C/EBPβ→アポB遺伝子の発現低下の分子機構が明らかとなりました。先に述べたように、小腸におけるカイロミクロン合成抑制は血中脂質パラメーターの改善や抗メタボリックシンドローム効果が報告されています。アポBはカイロミクロン形成に重要であることから、今回の発見はケルセチンによる新たな脂質代謝改善効果の可能性を示したと考えられます(図2)。
発表雑誌
- 雑誌名
- PLoS One
- 論文タイトル
- Quercetin Represses Apolipoprotein B Expression by Inhibiting the Transcriptional Activity of C/EBPβ
- 著者
- Makoto Shimizu, Juan Li, Jun Inoue, Ryuichiro Sato
- DOI番号
- 10.1371/journal.pone.0121784
- 論文URL
- http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0121784
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生化学研究室
教授 佐藤 隆一郎
Tel:03-5841-5136
Fax:03-5841-8029
研究室URL:http://webpark1213.sakura.ne.jp/
用語解説
- 注1 リポタンパク質
- タンパク質と脂質の複合体。食事由来の脂質は、小腸で吸収された後にアポBなどのアポリポタンパク質と共にカイロミクロンと呼ばれるリポタンパク質を形成し、肝臓に運搬される。
- 注2 アポB(アポリポタンパク質B)
- カイロミクロンの主要なアポリポタンパク質の一つ。アポBの産生は小腸と肝臓に限定されており、その発現はC/EBPβをはじめとする様々な転写因子により調節されている。肝臓においてはVLDL(超低密度リポタンパク質)の主要な構成タンパク質として機能している。
- 注3 C/EBPβ(CCAAT/enhancer-binding protein)
- 遺伝子プロモーター上のCCAATボックスと呼ばれるDNA配列に結合し、標的遺伝子の発現を活性化する転写因子。主に小腸、肝臓、脂肪組織に発現している。C/EBPには6つのサブタイプが存在する。その中でC/EBPβとC/EBPαはアポリポタンパク質の発現を調節することが報告されている。