共生細菌ヴォルバキアの「オス殺し」は宿主昆虫のオス化因子の発現を抑制することで達成される
- 発表者
-
福井 崇弘(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 修士課程1年)
川本 宗孝(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 学術支援専門職員)
庄司 佳祐(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 博士課程2年)
木内 隆史(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 助教)
菅野 純夫(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 教授)
嶋田 透(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 教授)
鈴木 穣(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 教授)
勝間 進(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 准教授)
発表のポイント
◆共生細菌による宿主の生殖操作メカニズムの一端を解明しました。
◆共生細菌による宿主昆虫のオス殺しの分子メカニズムを初めて明らかにしました。
◆病原体による新しい宿主制御メカニズムが明らかになるとともに、それを模倣した昆虫制御技術の開発が期待できます。
発表概要
病原体の中には、自己の利益のために宿主を様々な方法で操作するものが存在します。共生細菌であるヴォルバキア(注1)はその1つであり、宿主の生殖システムを操作することで次世代への感染拡大を図っていると考えられています。チョウ目昆虫であるアワノメイガ類においては、ヴォルバキア感染によってオスのみが致死する「オス殺し」現象が知られていましたが、その分子メカニズムは未解明でした。今回、東京大学大学院農学生命科学研究科の勝間進准教授のグループは、ヴァルバキアに感染したアワノメイガの胚子において、アワノメイガの雄化と遺伝子量補償(注2)を司るMasculinizer遺伝子(Masc)のmRNA量が顕著に低下していることを発見しました。また、このMasc mRNA量の低下がZ染色体における遺伝子量補償の破綻を引き起こし、それが「オス殺し」の原因となっていることを明らかにしました。本研究成果は、病原体が宿主の性決定カスケードをハイジャックする新しい宿主制御メカニズムを発見したものです。本研究を足がかりにして、病原体による宿主の生殖操作に関する研究が進展することが期待されます。
発表内容

図1 「オス殺し」アワノメイガ成虫,川本宗孝が撮影(拡大画像↗)
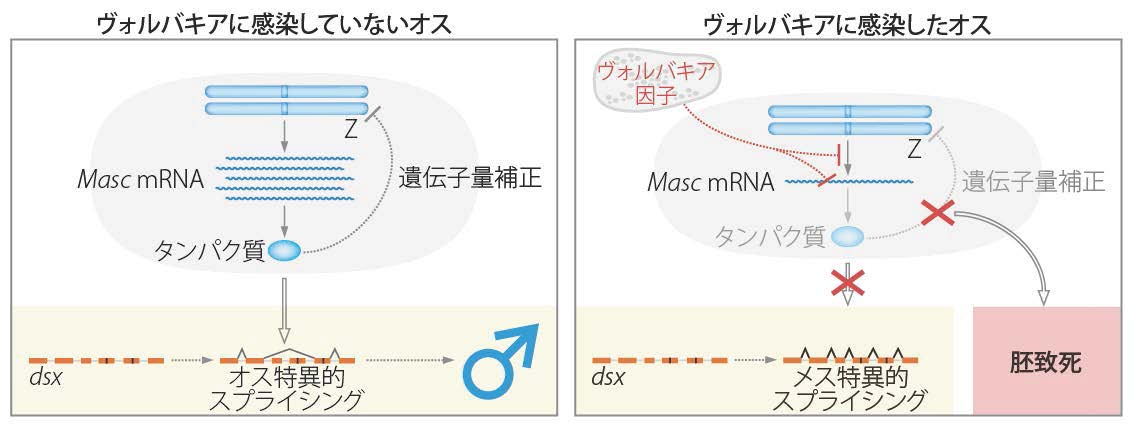
図2 ヴォルバキアによる「オス殺し」メカニズム.Fukui T et.al. (2015) The Endosymbiotic Bacterium Wolbachia Selectively Kills Male Hosts by Targeting the Masculinizing Gene. PLOS Pathogens.Fig.6を改変(拡大画像↗)
病原体の中には、自己の利益のために、宿主の行動や生殖を変化させるものが存在します。例えば、昆虫ウイルスの一種であるバキュロウイルスは、進化の過程で宿主から獲得したと考えられる遺伝子の機能を改変して、宿主の行動を巧みに操作していることが明らかになっています(http://www.a.u-tokyo.ac.jp/topics/2012/20120410-6.html)。一方、ヴォルバキアは65%以上の昆虫種に感染している共生細菌であり、古くから宿主昆虫の生殖操作を行うことが知られています。チョウ目昆虫であるアワノメイガ類においては、ヴォルバキア感染によってオスのみが致死する「オス殺し」現象が知られていましたが、それがどのような機構で制御されているのか、その詳細な分子メカニズムは未解明でした。今回、東京大学大学院農学生命科学研究科の勝間進准教授のグループは、ヴォルバキアに感染したアワノメイガを用いて、「オス殺し」メカニズムの一端を解明することに成功しました。
勝間准教授のグループは、2014年にカイコにおいて雄化と遺伝子量補償を担う分子としてMasc遺伝子を同定しています(http://www.a.u-tokyo.ac.jp/topics/2014/20140515-1.html)。RNA干渉法によってカイコのオス胚子でMasc mRNA量を低下させると、性分化のマーカーであるdoublesex (dsx)のスプライシングがメス型になり、遺伝子量補償が破綻することで胚致死してしまいます。このカイコにおける実験ではメスは胚致死しないことから、人為的に「オス殺し」現象を再現できたと言えます。そこで、ヴォルバキアによる「オス殺し」のターゲットがMascまたはその下流の因子であると仮定し、本研究を開始しました。まず、野外よりアワノメイガを採集し、その中でヴォルバキアに感染し、かつ「オス殺し」の表現型を示す個体を系統化しました(図1:「オス殺し」アワノメイガ成虫)。つぎに、胚子におけるdsxのスプライシングパターンを調査したところ、胚発生の初期の段階ですでに性操作が行われていることがわかりました。そこで、発生初期段階のヴォルバキア感染胚子、および非感染胚子を用いてRNA-seq(注3)によるトランスクリプトーム解析を行い、胚子期における遺伝子発現について網羅的に調査をしました。その結果、アワノメイガのMasc mRNA量はヴォルバキア感染胚子において顕著に低下していることが判明しました。また、染色体ごとに遺伝子発現量を調査した結果、ヴォルバキア感染胚子においてはZ染色体の遺伝子発現だけが異常になっていることがわかりました。これらの結果から、Masc の発現低下による遺伝子量補償の破綻が起こり、その結果としてオス特異的胚致死、すなわち「オス殺し」が起きている可能性が強く示唆されました。この仮説を実証するために、ヴォルバキア感染胚子に人工的に合成したMasc cRNAを注射することで「オス殺し」を回避できないか検討しました。その結果、コントロールのcRNAを注射した胚子からは「オス殺し」の結果としてメスのみが孵化してきましたが、Masc cRNAを注射した胚子からはオスの孵化も確認することができました。この結果は、Masc mRNA量の低下が「オス殺し」の原因であることを示すものです(図2:ヴォルバキアによる「オス殺し」メカニズム)。
本研究成果は、ヴォルバキアが宿主の性決定カスケードをハイジャックする宿主制御メカニズムを初めて解明したものです。今後はヴォルバキアが持つMasc制御因子の同定を行うことで、病原体による巧みな性操作メカニズムが解明されると考えられます。また、本研究を足がかりにして、害虫防除をはじめとしたチョウ目昆虫の性操作技術の開発と応用が期待されます。
本研究は、農林水産省のイノベーション創出基礎的研究推進事業「チョウ目昆虫における性操作技術の開発」(平成26年度より農林水産業・食品 産業科学技術研究推進事業に移管)、および文部科学省科学研究費補助金(挑戦的萌芽研究)による支援を受けて行われました。
発表雑誌
- 雑誌名
- 「PLoS Pathogens」
- 論文タイトル
- The Endosymbiotic Bacterium Wolbachia Selectively Kills Male Hosts by Targeting the Masculinizing Gene
- 著者
- Takahiro Fukui, Munetaka Kawamoto, Keisuke Shoji, Takashi Kiuchi, Sumio Sugano, Toru Shimada, Yutaka Suzuki, and Susumu Katsuma
- DOI番号
- 10.1371/journal.ppat.1005048
- 論文URL
- http://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1005048
問い合わせ先
東京大学大学院農学生命科学研究科 生産・環境生物学専攻 昆虫遺伝研究室
准教授 勝間 進
Tel:03-5841-8994
Fax:03-5841-8993
研究室URL:http://papilio.ab.a.u-tokyo.ac.jp/igb/
用語解説
- 注1 ヴォルバキア
- ヴォルバキアはα-proteobacteriaに属するリケッチアに近縁な細胞内共生微生物であり、昆虫で広く感染が認められている。ヴォルバキアの唯一の感染経路は卵細胞質を通じた母子感染であるため、宿主の生殖システムを様々な方法で操作することで次世代への感染拡大を図っている。そのうちの一つが「オス殺し」と呼ばれる現象であり、アズキノメイガにおける例が報告されている(http://www.a.u-tokyo.ac.jp/topics/2012/20120106-1.html)。
- 注2 遺伝子量補償
- 雌雄における性染色体数の不均等から生じる遺伝子の発現量の差を、雌雄で等しくなるように調節する機構のこと。例えば、ヒトでは雌で2本あるX染色体のうちの片方を不活化することでバランスを維持しているが、同じ雄XY/雌XXの性染色体構成を持つキイロショウジョウバエでは、遺伝子量補償の分子機構は大きく異なっている。
- 注3 RNA-seq
- 次世代シークエンサーによって転写産物の配列を決定する手法。配列の出現比率から各遺伝子の転写量を推定することが出来る。