微生物によるバイオ燃料生産の鍵となる酵素のしくみを解明 - 酸化的セルロース分解の「ミッシングリンク」 -
- 発表者
-
南 ヨンウ(東京大学大学院農学生命科学研究科応用生命工学専攻 大学院生;当時)
仁平 高則(新潟大学大学院自然科学研究科 食品製造学研究室 特任助教)
荒川 孝俊(東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
斉藤 由華(新潟大学大学院自然科学研究科 食品製造学研究室 大学院生;当時)
北岡 本光(農研機構食品総合研究所 食品バイオテクノロジー研究領域 上席研究員)
中井 博之(新潟大学大学院自然科学研究科 食品製造学研究室 准教授)
伏信 進矢(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
発表のポイント
◆近年、セルロースを酸化的に分解する酵素が注目を集めていますが、そこでできる「セロビオン酸」(注1)を微生物がどのようにして利用するのかは、わかっていませんでした。
◆微生物から発見した酵素「セロビオン酸ホスホリラーゼ」(注2)のかたちと作用メカニズムを明らかにしました。
◆「セロビオン酸ホスホリラーゼ」は微生物が植物のバイオマスを分解した後にエタノールなどを発酵生産する代謝経路で鍵となるため、バイオ燃料生産技術を開発する上で重要な情報が得られました。
発表概要
これまで微生物によるセルロースの分解には主に加水分解酵素(セルラーゼ:注3)が関わるとされていましたが、近年、その効率を飛躍的に増大させる酸化的セルロース分解酵素の存在が注目されています。セルロースがこれらの酵素により分解されると、セロビオン酸ができますが(図1)、それがどのように代謝されるかは全く分かっていませんでした。そのような状況のもと、2013年に新しい酵素「セロビオン酸ホスホリラーゼ(CBAP)」が新潟大学大学院自然科学研究科の中井博之准教授らの研究グループにより発見されました。CBAPがセロビオン酸に作用すると、発酵に利用されやすい化合物に分解されます。この酵素は微生物による酸化的セルロース分解と発酵の代謝経路をつなぐ、いわば「ミッシングリンク(失われた環)」のような存在であることが解明されていました。
今回、東京大学大学院農学生命科学研究科の伏信進矢教授らの研究グループは、中井准教授らと共同で、CBAPの立体構造をX線結晶構造解析(注4)により初めて解明しました(図2)。セロビオン酸と結合した状態のCBAPの構造を決定し(図3)、その作用メカニズムを詳細に明らかにしました。
本成果は、学術的に興味深い結果がえられただけでなく、微生物を利用してセルロースを分解し、エタノールなどのバイオ燃料や様々な化合物を発酵生産する「バイオリファイナリー」(注5)の技術開発においても、重要な情報をもたらしました。
発表内容
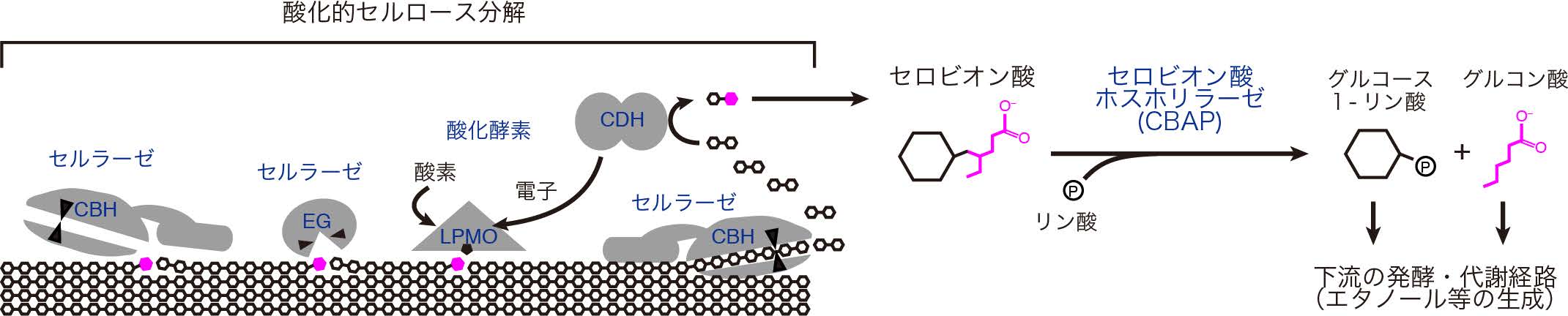
図1 微生物の酵素による酸化的セルロース分解とCBAPの反応
セルラーゼ(加水分解酵素)にはセルロース鎖を両端から切断するセロビオヒドロラーゼ(CBH)、セルロース鎖を中ほどから切断するエンドグルカナーゼ(EG)が含まれる。酸化酵素である溶解性多糖モノオキシゲナーゼ(LPMO)とセロビオース脱水素酵素(CDH)は電子を受け渡すことにより協同的に作用すると考えられている。LPMOにより生じた切断箇所には、セルラーゼがとりつきやすくなる。酵素の名前を青字で示し、酸化により生じた部分をマゼンタで表した。(拡大画像↗)
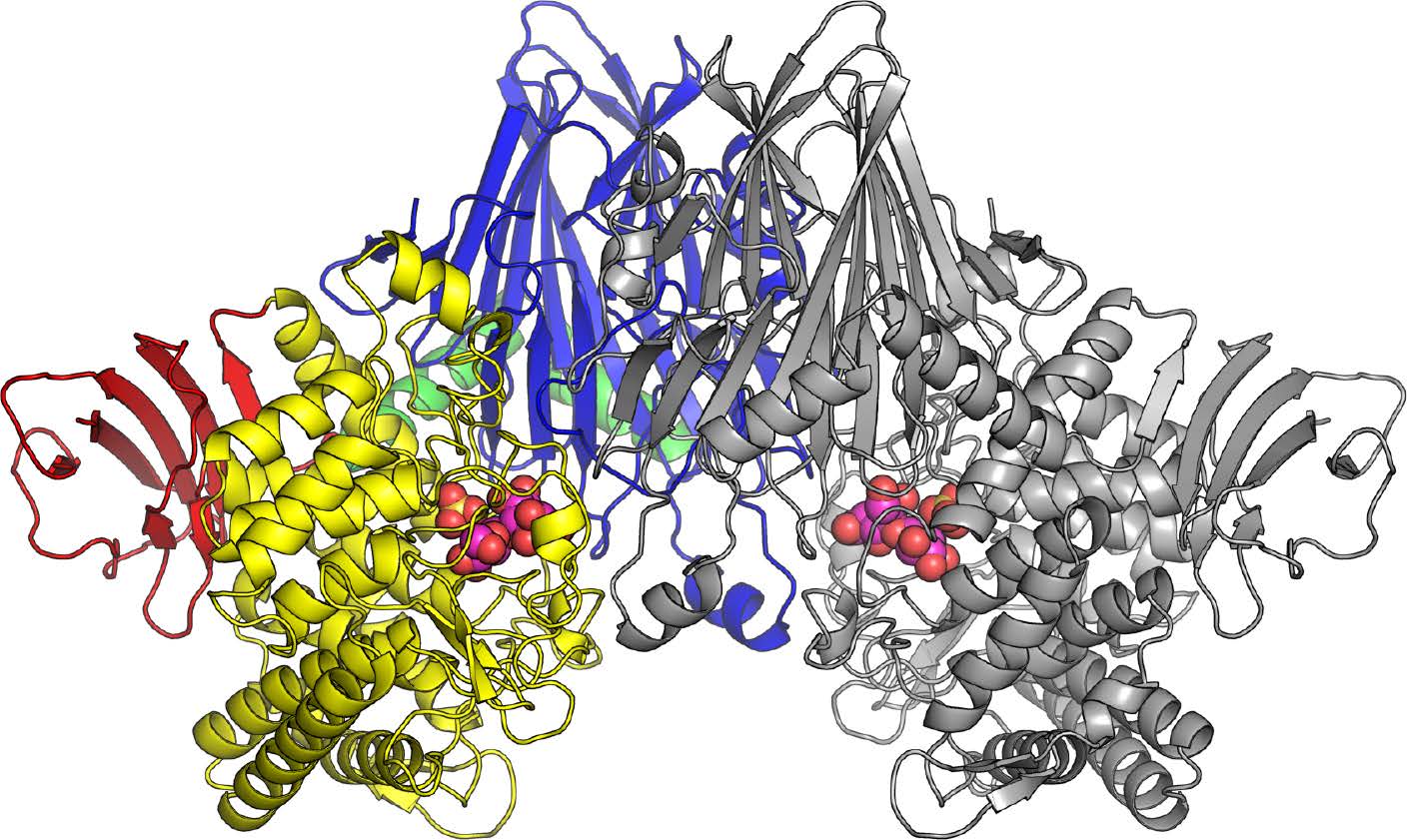
図2 CBAPの全体構造
CBAPは二つの酵素分子が結合した二量体の状態で存在する。左半分の色のついた部分と、右半分の灰色の部分がそれぞれ一つの酵素分子。CBAPに結合したセロビオン酸と硫酸イオン(リン酸類似化合物)は球で表した。(拡大画像↗)
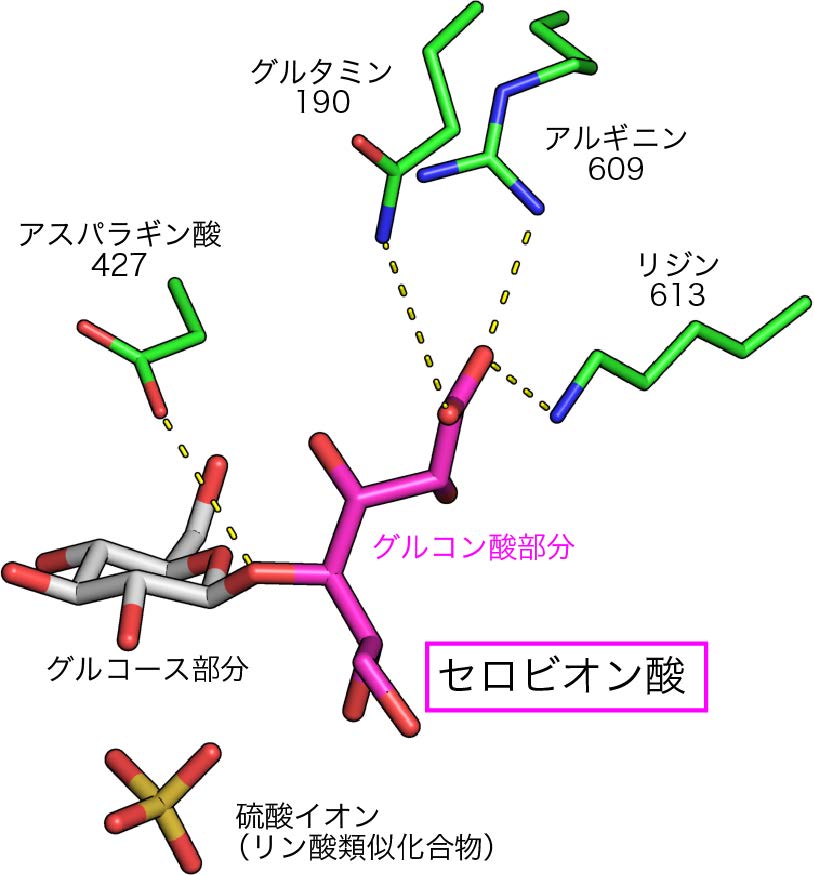
図3 CBAPの触媒部位の構造
セロビオン酸はグルコース部分(灰色)とグルコン酸部分(マゼンタ)に分けられる。CBAPのアミノ酸残基を緑色で表した。セロビオン酸の切断には、リン酸と427番目のアスパラギン酸が関わり、グルコン酸部分の結合には、609番目のアルギニン、613番目のリジン、190番目のグルタミンが関わる。(拡大画像↗)
植物の細胞壁の約半分を占めるセルロースは地球上で最も豊富に存在する有機物であり、澱粉や蔗糖などの可食性の生物資源(バイオマス)と競合しない再生可能な生物資源として大規模な利用が望まれています。セルロースを分解する酵素として、微生物が作る一群の加水分解酵素(セルラーゼ)が古くから研究されていましたが、近年、溶解性多糖モノオキシゲナーゼ(LPMO:注6)と呼ばれる新たな酵素が発見されて注目を浴びています。LPMOは非常に硬い固体であるセルロースの表面にとりつき、酸素を利用して切断することによりその表面に「引っかき傷」を作り、セルラーゼが作用しやすくなります(図1)。従って、LPMOはセルラーゼの活性を飛躍的に増強する「ブースター」として利用されています。このような酸化酵素とセルラーゼが働いて生成する主な産物はセロビオン酸ですが、セルロースを分解する微生物が、セロビオン酸をどのようにして代謝し、エタノールなどの発酵へと導いているかは全く分かっていませんでした。そのような状況のもと、2013年に、新潟大学大学院自然科学研究科の中井博之准教授、農研機構食品総合研究所食品バイオテクノロジー研究領域の北岡本光上席研究員、東京大学大学院農学生命科学研究科の五十嵐圭日子准教授らの研究グループにより、この酸化的セルラーゼ分解と発酵経路の「ミッシングリンク(失われた環)」にあたる酵素「セロビオン酸ホスホリラーゼ(CBAP)」が発見されました。CBAPはセロビオン酸にリン酸を付加しながら切断し(加リン酸分解)、グルコース1−リン酸とグルコン酸を生成します。これらの産物は、解糖系やペントースリン酸回路といったよく知られている代謝経路に入ります。従って、CBAPは微生物の酸化的セルロース分解と発酵の2つの経路をつなぐ鍵酵素であると言えます。しかし、CBAPの立体構造は分かっておらず、この酵素がどのようにして基質を結合し、反応を触媒しているのかは不明でした。
今回、東京大学大学院農学生命科学研究科の伏信進矢教授の研究グループが中心となり、CBAPの高分解能の三次元構造を、X線結晶構造解析の技術を用いて初めて明らかにしました(図2)。また、決定された構造を基に点変異体(注7)を用いた機能解析を行い、CBAPの基質認識と反応のメカニズムを解明しました。
本研究では、米国チェサピーク湾から単離されたセルロース分解能力を持つ海洋性細菌(サッカロファガス・デグラダンス)から、CBAPの遺伝子を取得して実験に用いました。本研究グループは、高エネルギー加速器研究機構(KEK)物質構造科学研究所のフォトンファクトリー(注8)のBL‐17AとNW-12Aを利用して、セロビオン酸と硫酸イオン(リン酸の類似化合物)が結合した状態(図3)を含めて4種類の結合状態の構造を明らかにしました。セロビオン酸の結合部位のうち、グルコース部分の結合に関わる部分は他の類似酵素と似ていましたが、グルコン酸部分の結合に関わる部分は全く新しい構造であることが分かりました。さらに、点変異体を用いた機能解析を行なった結果、グルコン酸結合部位に存在する609番目のアルギニン、613番目のリジン、そして190番目のグルタミンが、基質の結合に重要な役割を担っていることが明らかになりました。また、グルコース部分の近くに位置するリン酸と、切断される結合の近くに位置する472番目のアスパラギン酸が触媒に重要であることも明らかになりました。
CBAPは生物のエネルギー通貨であるアデノシン三リン酸(ATP)を消費することなく高エネルギーの産物(グルコース1−リン酸)を生成して下流の経路に送るため、微生物にとっては省エネルギー型の代謝経路であるといえます。従って、CBAPを持つ微生物は、酸化的セルロース分解の産物であるセロビオン酸から効率的に発酵を行い、エタノールなどの産物を作ることができます。微生物の酵素によるセルロース系バイオマスの利用法の開発は現在精力的に行われており、多糖の分解(糖化)プロセスと発酵プロセスを同時に行う一貫バイオプロセスの構築が重要視されています。本研究の成果は、バイオマスからバイオ燃料や様々な化学製品を作るバイオリファイナリー技術を開発する上で重要な基礎的情報となります。
なお、本研究は、農林水産省の農林水産業・食品産業科学技術研究推進事業「酵素工学を活用した糖質資源高度利用プラットフォーム構築」による支援を受けて行われました。
発表雑誌
- 雑誌名
- 「The Journal of Biological Chemistry」
- 論文タイトル
- Crystal structure and substrate recognition of cellobionic acid phosphorylase playing a key role in oxidative cellulose degradation by microbes
- 著者
- Young-Woo Nam, Takanori Nihira, Takatoshi Arakawa, Yuka Saito, Motomitsu Kitaoka, Hiroyuki Nakai, and Shinya Fushinobu
- DOI番号
- 10.1074/jbc.M115.664664
- 論文URL
- http://dx.doi.org/10.1074/jbc.M115.664664
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命工学専攻 酵素学研究室
教授 伏信 進矢
Tel:03-5841-5151
Fax: 03-5841-5151
研究室URL:http://enzyme13.bt.a.u-tokyo.ac.jp/
用語解説
- 注1 セロビオン酸
- グルコースとグルコン酸が結合した化合物。
- 注2 セロビオン酸ホスホリラーゼ
- リン酸を基質としてセロビオン酸を切断(加リン酸分解)する酵素。ホスホリラーゼは一般的にその逆反応(合成反応)も効率よく触媒するため、オリゴ糖などの合成にも用いられる。
- 注3 セルラーゼ
- 水を利用してセルロース鎖を切断(加水分解)する一群の酵素。両端から二糖単位を切断するセロビオヒドロラーゼ(CBH)、セルロース鎖の中ほどを切断するエンドグルカナーゼ(EG)などがセルラーゼに含まれる。セルラーゼの基質結合部位は溝やトンネルのようなかたちをしており、そのままでは硬い固体であるセルロースの表面に作用しにくい。
- 注4 X線結晶構造解析
- 酵素を含むタンパク質の立体構造を明らかにするための最も一般的な方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることができる。
- 注5 バイオリファイナリー
- 石炭・石油などの化石資源に頼らずに、植物のセルロース・ヘミセルロース・リグニンや甲殻類のキチンなど、再生可能な生物資源(バイオマス)を原料として、バイオ燃料やバイオプラスチック(樹脂)などの化学製品および素材を製造する技術。
- 注6 溶解性多糖モノオキシゲナーゼ(LPMO)
- 2010〜2011年に発見された酵素で、酸素を利用してセルロース鎖を切断する。セルロースの硬い表面にとりつき、「引っかき傷」のような切断箇所を作るため、セルラーゼが作用しやすくなる。もう一つの酸化酵素であるセロビオース脱水素酵素(CDH)から電子を受け取り、共同して働くと考えられている。LPMOが生成する末端にCBHが作用したり、CBHが生成する二糖にCDHが作用することにより、セロビオン酸が生成される。
- 注7 点変異体
- 酵素の特定のアミノ酸残基を別のアミノ酸残基に置換したもの。目的の残基に変異を入れることで酵素の活性が変われば、その残基の役割を推定できる。
- 注8 フォトンファクトリー
- 光(Photon)の工場(Factory)の愛称で親しまれているフォトンファクトリー(PF)は、日本初のX線を利用できる放射光専用光源として1982年に完成した。大学や研究機関が共同で利用実験するための施設(大学共同利用機関)としてKEKで運用され、年間約3千名を超える国内外の研究者が実験に訪れ、物質科学・生命科学の基礎から応用に至る世界最先端の研究成果を創出している。