バキュロウイルスによる翻訳制御メカニズムの解明
- 発表者
-
John J. Li(Department of Molecular Genetics, University of Toronto)
Chune Cao(Eunice Kennedy Shriver National Institute of Child Health and Human Development, National Institutes of Health)
Sarah M. Fixsen(Department of Human Genetics, University of Utah School of Medicine)
Janet M. Young(Division of Basic Sciences, Fred Hutchinson Cancer Research Center)
小野 慎子(北海道大学大学院農学研究院 応用分子生物学分野 博士課程3年;当時)
伴戸 久徳(北海道大学大学院農学研究院 応用分子生物学分野 教授)
Nels C. Elde(Department of Human Genetics, University of Utah School of Medicine)
*勝間 進(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 准教授)
*Thomas E. Dever(Eunice Kennedy Shriver National Institute of Child Health and Human Development, National Institutes of Health)
*Frank Sicheri (Department of Molecular Genetics, University of Toronto)
(*責任著者)
発表のポイント
◆バキュロウイルスが持つキナーゼインヒビターの作用機序と役割を明らかにしました。
◆バキュロウイルスが持つPK2タンパク質が、宿主のキナーゼを新しい様式で阻害すること、およびその結果として宿主の翻訳抑制を解除し、ウイルスの増殖を正に制御していることがわかりました。
◆PK2タンパク質による新規な翻訳制御メカニズムが明らかになったことで、ウイルスによる宿主制御メカニズムの理解が進展することが期待されます。
発表概要
細胞は外界からストレスを受けると、翻訳開始因子のサブユニットであるeIF2αのリン酸化を介した翻訳抑制を実行します。ウイルスに感染した場合もeIF2αのリン酸化を介した翻訳抑制が引き起こされることが知られています。これまでの研究によって、昆虫ウイルスの1種であるバキュロウイルスがPK2タンパク質を利用して宿主のeIF2αのリン酸化を抑制し、翻訳抑制を解除することが明らかになっていますが、その詳細な分子メカニズムについては未解明でした。今回、東京大学大学院農学生命科学研究科の勝間進准教授は、トロント大学、National Institutes of Health、ユタ大学、北海道大学のグループとの共同研究によって、バキュロウイルスが持つPK2の機能解析を行いました。その結果、PK2は宿主である昆虫細胞のeIF2αリン酸化酵素(キナーゼ)の一つであるHeme-Regulated Inhibitor kinase (HRI)のインヒビターとして機能すること、およびその阻害様式が新しい様式であることを明らかにしました。すなわち、バキュロウイルスはPK2を用いてeIF2αのリン酸化を阻害することで、宿主細胞の翻訳抑制を解除し、自身を効率的に増殖させることがわかりました。この発見を足がかりに、バキュロウイルスによる宿主制御メカニズムの解明や新たな遺伝子発現ベクターの開発が期待されます。
発表内容
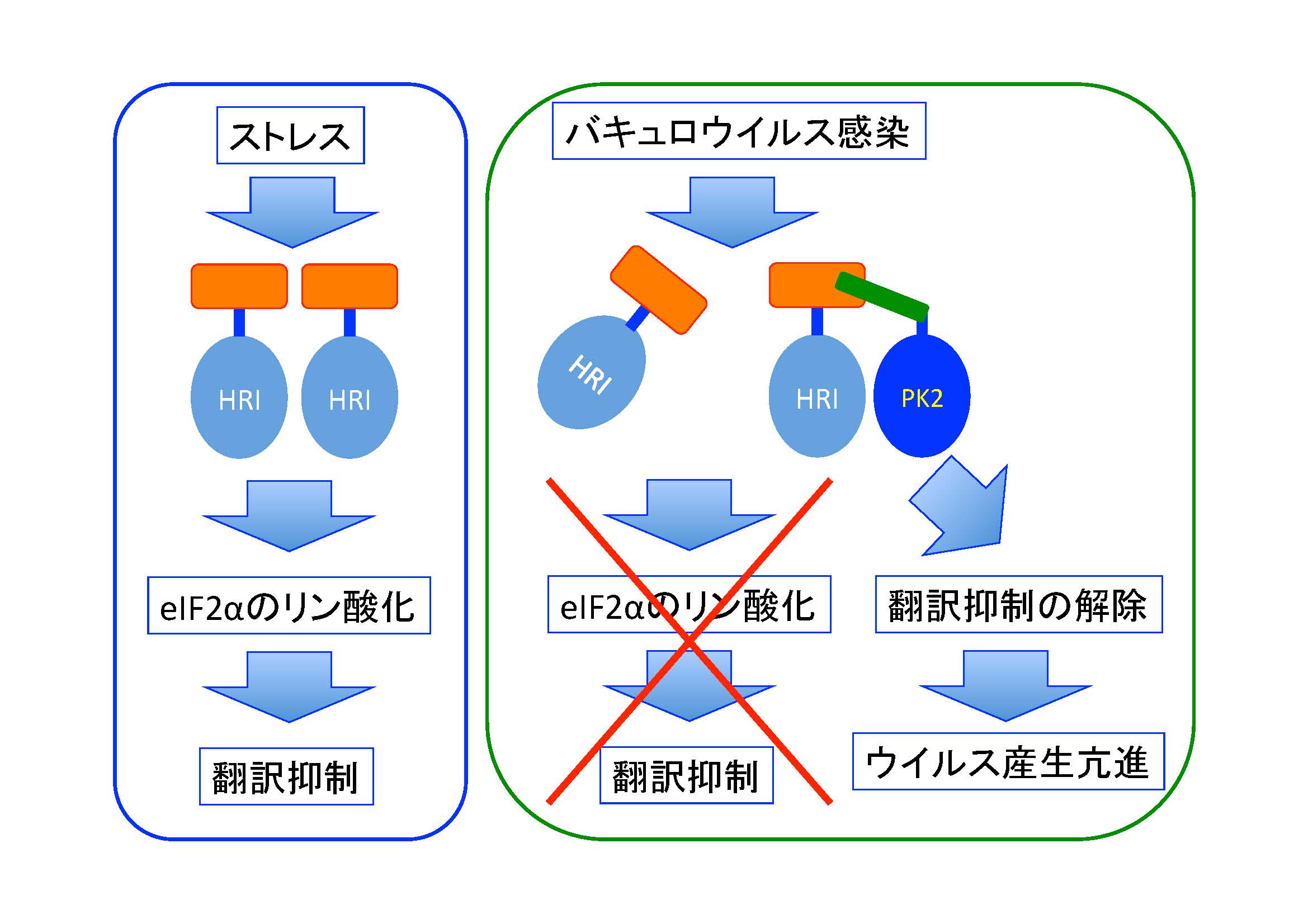
図1 バキュロウイルスが持つPK2タンパク質の感染細胞における作用機序(拡大画像↗)
細胞は外界から様々なストレスを受けますが、その刺激によってタンパク質の翻訳を抑制することがあります。この翻訳抑制は、翻訳開始因子のサブユニットであるeIF2αのリン酸化を介して行われます。eIF2αのリン酸化を行う酵素(eIF2αキナーゼ)はストレスの種類によって異なることが知られており、ヒトにおいてはウイルス感染時のRNA dependent Protein Kinase (PKR)、アミノ酸飢餓によるGeneral Control Nonrepressible-2 kinase (GCN2)、小胞体ストレスによるPKR-like Endoplasmic Reticulum Kinase (PERK)、およびヘム鉄欠乏時のHeme-Regulated Inhibitor kinase (HRI)の4種類が存在します。チョウ目昆虫であるカイコには、このうちPKRを除く3種類が存在します。一方、カイコを宿主とするバキュロウイルス(注1)のゲノム上には、eIF2αキナーゼと相同性のあるタンパク質をコードする遺伝子pk2が存在します。National Institutes of HealthのDever博士のグループは、PK2タンパク質がバキュロウイルス感染時の昆虫細胞におけるeIF2αのリン酸化を阻害すること、および昆虫細胞に導入したヒトPKRの活性を阻害することを発見しています。これらの結果から、PK2が宿主細胞のeIF2αキナーゼを阻害することで、宿主の翻訳抑制を解除していることが推測されていました。しかし、PK2のターゲット分子や阻害様式、およびウイルス増殖における役割は未解明のままでした。
今回、東京大学大学院農学生命科学研究科の勝間進准教授らのグループは、トロント大学、National Institutes of Health、ユタ大学、北海道大学のグループとの共同研究によって、PK2のターゲットとその阻害様式、およびウイルス感染における役割を調査しました。まず、ヒトPKRを用いた生化学実験により、PK2はeIF2αキナーゼと相同性のあるドメインではなく、N末端の22アミノ酸からなる領域を利用してeIF2αキナーゼと結合することがわかりました。その中でも18番目のフェニルアラニン(Phe18)が結合に必須であることが明らかになりました。つまり、PK2はeIF2αキナーゼと結合し2量体化を阻止することで、キナーゼ活性を阻害していることがわかりました。つぎに、PK2のウイルス感染における役割を調査するために、pk2を欠損した組換えバキュロウイルスを作成し、培養細胞、およびカイコ幼虫における性状を解析しました。その結果、pk2を欠損するとウイルス産生量が低下し、カイコ幼虫における病原性も顕著に低下しました。一方、pk2欠損ウイルスにpk2を再導入したウイルスは野生株と同様な病原性を示しましたが、Phe18をアラニンに置換したPK2を発現するウイルスは欠損ウイルスと同様、病原性が低下していました。さらに、pk2欠損ウイルスやPhe18変異ウイルスに感染した細胞では、eIF2αのリン酸化の抑制は観察されませんでした。以上のことから、PK2は宿主のeIF2αキナーゼとN末端領域を介して結合し、eIF2αのリン酸化を抑制することで、自身の増殖を正に制御していることが分かりました。最後に、昆虫細胞におけるPK2のターゲットを調査するために、RNAi法(注2)によってカイコの3 種類のeIF2αキナーゼ遺伝子をノックダウンし、その際のウイルス増殖を調査しました。その結果、HRIをコードするBmHRIをノックダウンした場合のみ、pk2欠損ウイルスにおけるウイルス産生が回復することが明らかになりました。このことから、バキュロウイルスのPK2のターゲットはHRIであることが示唆されました(図1:バキュロウイルスが持つPK2タンパク質の感染細胞における作用機序)。
本研究成果によって、バキュロウイルスが持つPK2タンパク質が、宿主のキナーゼを新しい様式で阻害すること、およびその結果として宿主の翻訳を抑制し、ウイルスの増殖を正に制御していることがわかりました。ウイルスタンパク質による新規な翻訳制御メカニズムが明らかになったことで、ウイルスによる宿主制御メカニズムの理解が進展することが期待されます。本研究は、文部科学省科学研究費補助金(若手研究Aおよび基盤研究B)による支援を受けて行われました。
発表雑誌
- 雑誌名
- 「Proceeding of the National Academy of Science USA」
- 論文タイトル
- Baculovirus protein PK2 subverts eIF2α kinase function by mimicry of its kinase domain C-lobe
- 著者
- John J. Li, Chune Cao, Sarah M. Fixsen, Janet M. Young, Chikako Ono, Hisanori Bando, Nels C. Elde, *Susumu Katsuma, *Thomas E. Dever, and *Frank Sicheri
(*co-corresponding authors) - DOI番号
- 10.1073/pnas.1505481112
- 論文URL
- http://www.pnas.org/content/early/2015/07/22/1505481112.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 生産・環境生物学専攻 昆虫遺伝研究室
准教授 勝間 進
Tel:03-5841-8994
Fax:03-5841-8993
研究室URL:http://papilio.ab.a.u-tokyo.ac.jp/igb/
用語解説
- 注1 バキュロウイルス
- 80–180 kbpの2本鎖DNAをゲノムとする昆虫ウイルス。外来遺伝子を発現するためのベクターとして、広く利用されている。
- 注2 RNAi法
- RNA干渉 (RNA interference)と呼ばれる遺伝子発現が抑制される現象を利用して、目的の遺伝子と一致する二本鎖RNA断片を細胞に導入することにより、当該遺伝子の発現量を低下させる方法。