植物の高温に対する初期応答のメカニズムを解明 - 作物の高温ストレス耐性を向上させる技術開発への貢献に期待 -
- 発表者
-
大濱 直彦(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任研究員)
草壁 和也(東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程2年;研究当時)
溝井 順哉(東京大学大学院農学生命科学研究科 応用生命化学専攻 講師)
趙 慧美(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士課程1年)
小泉 慎也(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士課程2年)
高橋 史憲(国立研究開発法人理化学研究所 環境資源科学研究センター 研究員)
石田 哲也(東京大学生物生産工学研究センター 特任助教;研究当時)
柳澤 修一(東京大学生物生産工学研究センター 准教授)
篠崎 一雄(国立研究開発法人理化学研究所 環境資源科学研究センター センター長)
篠崎 和子(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
発表のポイント
◆植物の高温ストレスに対する初期段階の応答の制御機構を分子レベルで明らかにしました。
◆高温ストレス応答を誘導するマスター転写因子(注1)の活性化の仕組みや、その転写因子の下流で働く多くの遺伝子群の発現制御の仕組みを明らかにしました。
◆作物の高温ストレス耐性を向上させる技術開発への貢献が期待されます。
発表概要
東京大学と理化学研究所の共同研究グループは、植物が高温ストレスに応答する仕組みを分子レベルで明らかにしました。
植物は環境の変化に適応するため、状況に応じてさまざまな遺伝子を活性化します。特に高温ストレスに対する適応では、マスター転写因子であるHsfA1が活性化することで、熱ショックタンパク質(HSP、注2)や種々の転写因子の発現が起こります。しかし、高温ストレス時にHsfA1が活性化するメカニズムや、HsfA1の活性化だけで植物中で起こるすべての高温ストレス応答を引き起こすことができるのかは、分かっていませんでした。
今回、篠崎和子教授らの共同研究グループは、HsfA1内のリージョン1と名付けた領域がHsfA1自身の活性を抑える働きを持つことを明らかにしました。リージョン1を取り除いたHsfA1(Δ1)は恒常的に高い活性を持ち、Δ1を多く作らせた植物は高い高温ストレス耐性を示しました。ただし、Δ1は高温ストレス応答を部分的にしか引き起こさないため、完全な高温ストレス応答の誘導にはHsfA1だけでなく、他にも必要な因子が存在することが示されました。
この研究は、植物に効果的に高温ストレス耐性を付与する技術の開発に貢献すると期待されます。
発表内容
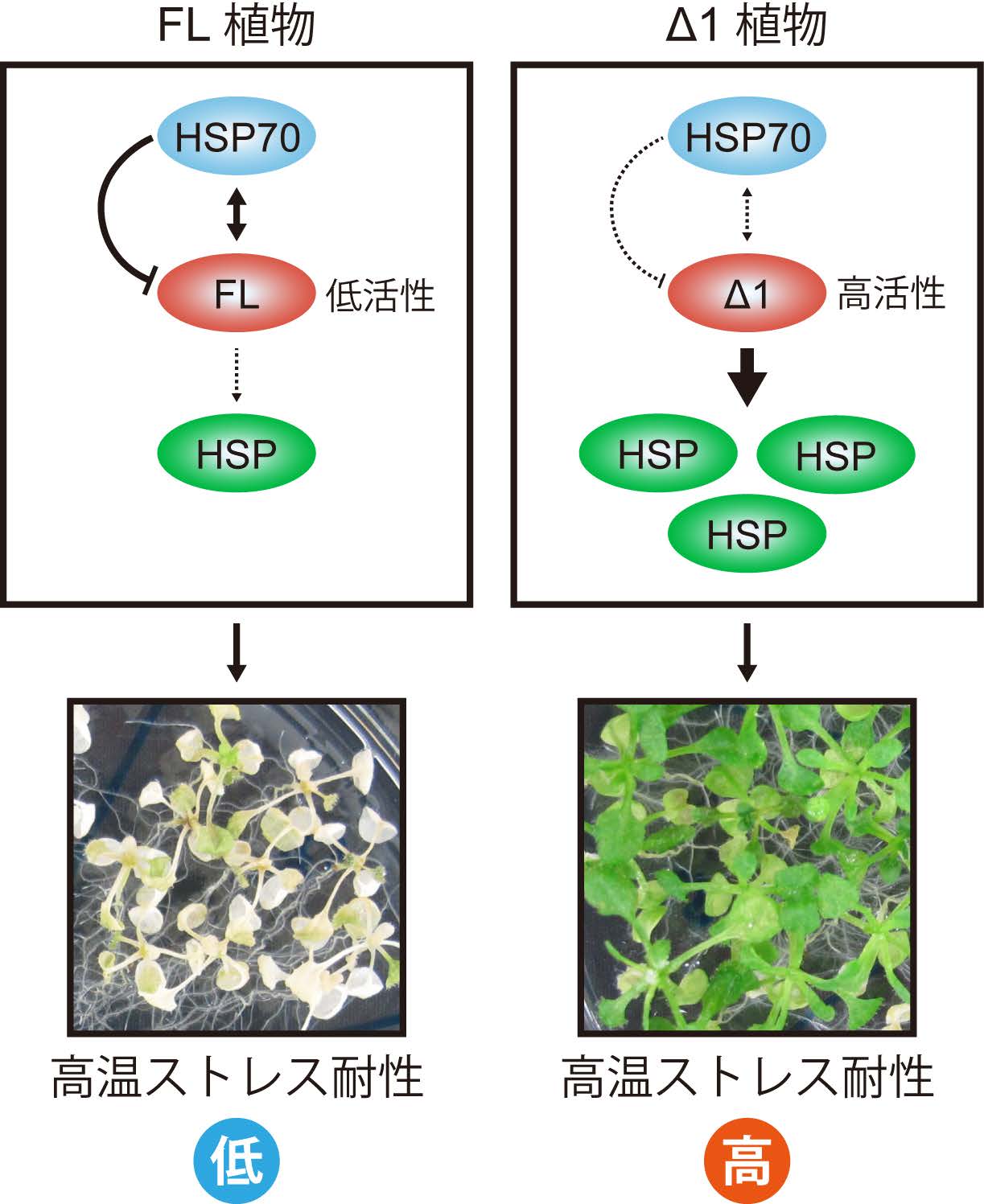
図1 FL植物中では、高温ストレス耐性遺伝子群を働かせるマスタースイッチであるHsfA1がHSP70に抑えられているので、活性が弱く高温ストレス耐性は低い。HsfA1のHSP70との結合部位であり、HsfA1の活性を抑えている領域であるリージョン1を除いたΔ1植物では、HsfA1が常に活性状態にあるため、たくさんの防御遺伝子(HSP)が働き高温ストレス耐性が向上する。(拡大画像↗)
高温ストレスは日周、年周の温度変化、熱波のように突発的な気象条件など、さまざまな要因で引き起こされる環境ストレスです。また、地球温暖化による気候の変動により、より頻繁に引き起こされる様になってきています。高温ストレスはタンパク質や細胞膜にダメージを与えることで、細胞活動に深刻な障害を起こします。高温ストレスにさらされた細胞では多数の防御遺伝子の発現が誘導されますが、この応答では熱ショック転写因子(HSF)が中枢制御因子として働くことが知られています。HSFは真核生物に保存された転写因子ですが、植物ではその種類が極めて多数存在しており、各HSFの機能が複雑に分化しています。共同研究グループは、これまでにこの多数のHSFのなかで、A1グループに分類されるHSF(HsfA1)が高温ストレス応答のマスター転写因子であることを明らかにしていました。HsfA1は常に少量存在しており、植物が高温ストレスを感知すると速やかに活性化されます。活性化したHsfA1は熱ショックタンパク質(HSP; 注2)などの防御遺伝子に加え、他のHSFをはじめとする転写因子群の発現も誘導し、一気に高温ストレス応答を増幅します。しかし、高温ストレス時にHsfA1が活性化するメカニズムや、HsfA1の活性化だけで高温ストレス応答を引き起こすのに十分なのかは分かっていませんでした。
今回、共同研究グループは、HsfA1タンパク質の活性制御領域の同定を試み、HsfA1自身の活性を抑えている領域を発見しました。この領域をリージョン1と名付けてさらに解析を進めると、リージョン1はストレスがない時にはHsfA1の活性を強く抑えますが、高温ストレス時にはその機能が弱まり、HsfA1の活性化につながることが分かりました。そのためリージョン1は、高温ストレスによって活性化するというHsfA1特有の仕組みを生み出す領域であると言えます。リージョン1の機能を植物体内で詳しく解析するため、全長のHsfA1(FL)、またはリージョン1を除いたHsfA1(Δ1)を多く作るシロイヌナズナ(それぞれFL植物、Δ1植物)を作出しました。すると、Δ1植物ではFL植物よりもはるかに強く防御遺伝子であるHSP遺伝子群が発現しており、高温ストレス耐性も著しく向上していることがわかりました。この結果は、リージョン1がHsfA1の活性を抑えるという考えを強く支持しています。
さらに共同研究グループは、リージョン1を介してHsfA1と結合し、HsfA1の活性を抑えるタンパク質が存在するのではないかと予想し、HsfA1の相互作用タンパク質を探索しました。すると、リージョン1に結合するHsfA1活性抑制因子としてHSP70が同定されました。HsfA1とHSP70の結合は高温ストレス処理によって減少したことから、リージョン1によるHsfA1活性制御の実体は、リージョン1を介したHSP70の結合とその解離であると考えられました。さまざまな植物のHsfA1のアミノ酸配列を比較すると、リージョン1のアミノ酸配列は非常に良く保存されています。その中でも特に保存性が高い部分については、新たな機能性領域としてTemperature-Dependent Repression domain(TDRドメイン)と名付けました。その保存性から、リージョン1(TDRドメイン)とHSP70によるHsfA1の活性制御は、植物の高温ストレス応答において普遍的な仕組みであると考えられます。
これまでの高温ストレス応答の制御モデルでは、マスター転写因子であるHsfA1の活性化が応答全体を誘導する引き金になると考えられていました。そのため、Δ1植物では高温ストレス応答が常に活性化されているのではないかと予想し、Δ1植物のトランスクリプトーム(注3)を解析しました。すると興味深いことに、Δ1植物ではHSPの発現は強く活性化されているものの、転写因子の発現はほとんど変化していないことがわかりました。この結果から、HSPと転写因子は共にHsfA1の制御下にあるものの、その制御には違いがあると考えられます。転写因子は高温ストレス応答を促進する働きを持つため、過剰に作り出すと無駄な応答が起きてしまいます。必要十分なレベルで高温ストレス応答を誘導するために、転写因子の発現はHsfA1以外の因子も関与した、より厳密な仕組みによって制御されていると考えられます。
リージョン1のアミノ酸配列の保存性から、本研究で明らかとなったHsfA1の活性制御機構はイネやダイズといった作物でも保存されていると考えられます。そのため、リージョン1とHSP70の相互作用をターゲットとした阻害剤の開発や、リージョン1のアミノ酸配列に着目した育種などにより、地球温暖化に対応した高温ストレス耐性を向上させた作物の開発への応用が期待されます。
発表雑誌
- 雑誌名
- 「The Plant Cell」
- 論文タイトル
- The transcriptional cascade in the heat stress response of Arabidopsis is strictly regulated at the level of transcription factor expression
- 著者
- Naohiko Ohama, Kazuya Kusakabe, Junya Mizoi, Huimei Zhao, Satoshi Kidokoro, Shinya Koizumi, Fuminori Takahashi, Tetsuya Ishida, Shuichi Yanagisawa, Kazuo Shinozaki, Kazuko Yamaguchi-Shinozaki*
- DOI番号
- 10.1105/tpc.15.00435
- 論文URL
- http://www.plantcell.org/content/early/2015/12/29/tpc.15.00435.abstract
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 植物分子生理学研究室
教授 篠崎 和子
Tel:03-5841-8137
Fax: 03-5841-8009
研究室URL:http://park.itc.u-tokyo.ac.jp/pmp/
用語解説
- 注1 転写因子
- DNAに結合し、遺伝子の働きを調節するタンパク質。マスター転写因子は、その因子が関与する現象を引き起こす上で必須な役割を担っている転写因子を指す。
- 注2 HSP(Heat shock protein)
- 熱ショックタンパク質、分子シャペロンとも呼ばれる。高温ストレスなどによって構造が破壊されたタンパク質に結合し、構造を修復したり、破壊されたタンパク質同士が凝集するのを防いだりする働きを持つ。
- 注3 トランスクリプトーム
- 細胞中に存在する全mRNAの総体を指す。興味のある状況に細胞をおいたとき、どのようなカテゴリーに属する遺伝子のmRNAが蓄積または減少しているかを調べることで、細胞がどのような反応を起こしているのか調べることができる。