腸脳軸を介した新しいエネルギー代謝調節機構を解明
- 発表者
-
牛尼 翔太(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士課程学生(当時))
石丸 喜朗(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任准教授)
成川 真隆(東京大学大学院農学生命科学研究科 応用生命化学専攻 助教)
吉岡 美紗子(東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程学生(当時))
小塚 智沙代(琉球大学大学院医学研究科 内分泌代謝・血液・膠原病内科学講座 講師)
渡辺 尚貴(芝浦工業大学システム理工学部生命科学科 修士課程学生(当時))
角田 誠(東京大学大学院薬学系研究科 生体分析化学教室 講師)
越阪部 奈緒美(芝浦工業大学システム理工学部生命科学科 教授)
朝倉 富子(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任教授)
益崎 裕章(琉球大学大学院医学研究科 内分泌代謝・血液・膠原病内科学講座 教授)
阿部 啓子(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任教授)
発表のポイント
◆転写因子Skn-1aが消化管刷子細胞への運命決定にも必須であることを明らかにしました。
◆Skn-1欠損マウスでは摂餌量は変わりませんでしたが、消費エネルギーが増加したために、低体脂肪率を伴う顕著な低体重を示しました。
◆消化管刷子細胞を標的とすることによって、肥満や糖尿病の新たな治療法の開発に繋がることが期待されます。
発表概要
味覚の情報や栄養素による刺激は口腔内や消化管で感知された後、腸脳軸を介して脳へ伝えられて、食行動やエネルギー代謝が制御されます。本研究では、味物質や食品由来化合物を受容する味細胞と消化管刷子細胞を起点として、脳を介して体重と体脂肪量が制御されるという新しい概念を提唱しました。今後、これらの細胞に作用する食品由来因子を探すことによって、肥満や糖尿病の新たな治療法の開発に繋がることが期待されます。
発表内容
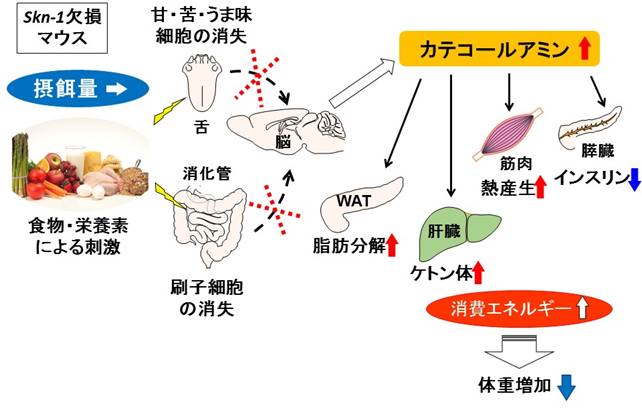
図1 消化管刷子細胞や味細胞を起点としたエネルギー代謝制御機構
Skn-1欠損マウスでは、消化管刷子細胞と甘・苦・うま味細胞が消失している。その結果、摂餌量は変わらないが、カテコールアミン分泌量の増加によって消費エネルギーが増えて、低体重を示した。刷子細胞や味細胞を起点とし、腸脳軸を介した新しい生体恒常性維持機構の存在が示唆された。(EBioMedicine in press, 2016より一部改変転載)(拡大画像↗)
小腸上皮には、吸収上皮細胞、杯細胞、パネート細胞、内分泌細胞という4種類の主要な細胞があります。さらに、小腸上皮細胞の約0.4%を占め、分化制御機構と細胞機能が不明である刷子細胞が存在します。我々のグループは以前、転写因子Skn-1a(Pou2f3)欠損マウスでは、味蕾の甘・苦・うま味細胞が完全に消失した結果、これらの味を全く感じられないことを報告しました(Matsumoto et al., Nature Neurosci. (2011))。本研究では、Skn-1aが味蕾同様に、消化管(胃・小腸)に存在する特定の細胞の分化も制御する可能性を検証しました。in situ hybridization法(注1)などを用いて発現解析を行った結果、Skn-1aは消化管刷子細胞に発現しており、Skn-1欠損マウスでは消化管刷子細胞も完全に消失していました。つまり、転写因子Skn-1aは消化管刷子細胞の分化も制御していることが示されました。
食品に含まれる味物質などの化合物は、口腔や消化管に存在する細胞によって受容されます。この情報は、求心性神経や液性因子(ホルモン、神経ペプチド等)を介して脳に到達・認知され、摂食行動やエネルギー代謝が制御されます。本研究では次に、消化管刷子細胞と甘・苦・うま味細胞の消失が摂食行動やエネルギー代謝に与える影響を調べました。興味深いことに、Skn-1欠損マウスは野生型マウスに比べて、普通食・高脂肪食のいずれにおいても、離乳直後の3週齢から体脂肪の低下を伴う体重減少を示しました。体重は摂取エネルギーと消費エネルギーのバランスで決まります。Skn-1欠損マウスは摂餌量には差がありませんでしたが、消費エネルギーが増加していました。消費エネルギーを上昇させるホルモンのうち、血清中甲状腺ホルモンに変化は見られませんでしたが、カテコールアミンの尿中分泌量がSkn-1欠損マウスで有意に増加しました。その結果、Skn-1欠損マウスでは、血清中総ケトン体の上昇、腓腹筋ミトコンドリアのコピー数増加、脂肪分解の亢進、および、インスリン分泌量が低下していることが示されました。
以上より、刷子細胞や味細胞を起点とし、脳を介して末梢組織(肝臓・筋肉・脂肪組織など)のエネルギー代謝を制御する新しい機構の存在が示唆されました。今後、これらの細胞に作用する食品由来因子を探すことによって、肥満や糖尿病の新たな治療法の開発に繋がることが期待されます。本研究は、琉球大学医学部などとの共同研究として実施されました。
発表雑誌
- 雑誌名
- 「EBioMedicine」
- 論文タイトル
- Catecholamines facilitate fuel expenditure and protect against obesity via a novel network of the gut-brain axis in transcription factor Skn-1-deficient mice
- 著者
- Ushiama, S.#, Ishimaru, Y.*, #, Narukawa, M.#, Yoshioka, M., Kozuka, C., Watanabe, N., Tsunoda, M., Osakabe, N., Asakura, T., Masuzaki, H., and Abe, K.*
(# These authors contributed equally to this work. * Corresponding authors) - DOI番号
- 10.1016/j.ebiom.2016.04.031
- 論文URL
- http://www.ebiomedicine.com/article/S2352-3964(16)30174-8/fulltext
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 味覚サイエンス(日清食品)寄付講座
特任准教授 石丸 喜朗
Tel:03-5841-1878
Fax:03-5841-1879
Email:ayishi@mail.ecc.u-tokyo.ac.jp
特任教授 阿部 啓子
Tel:03-5841-5129
Fax:03-5841-8006
Email:aka7308@mail.ecc.u-tokyo.ac.jp
研究室URL:http://park.itc.u-tokyo.ac.jp/tastescience/index.html
用語解説
- 注1 in situ hybridization法
- 目的の組織切片を用いて、ある遺伝子のmRNAが発現しているかを調べる方法。