根寄生植物由来KAI2タンパク質が発芽誘導物質を選択的に認識する機構
- 発表者
-
徐 玉群(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士課程)
宮川 拓也(東京大学大学院農学生命科学研究科 応用生命化学専攻 助教)
中村 英光(東京大学大学院農学生命科学研究科 応用生命化学専攻 助教)
中村 顕(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任助教)
今村 優作(東京大学大学院農学生命科学研究科 応用生命化学専攻 修士課程)
浅見 忠男(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
田之倉 優(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授)
発表のポイント
◆本研究は食糧生産に被害を及ぼす根寄生植物(注1)ストライガの発芽誘導に関わるKAI2タンパク質ShKAI2iBが、他のファミリータンパク質とは異なり、植物の発芽誘導物質のうちでカリキン(KAR)を選択的に結合することを明らかにしました。
◆ShKAI2iBのX線結晶構造解析によりKARの結合様式を明らかにし、KARに対するリガンド(注2)選択性の構造基盤を明らかにしました。
◆本成果は、ストライガKAI2タンパク質が発芽誘導物質を選択的に結合する機構の一端を明らかにしたもので、根寄生植物の発芽誘導機構の理解やストライガの発芽を制御する化合物の設計などに役立つことが期待されます。
発表概要
Striga属寄生植物(ストライガ)は、宿主とする植物の根から分泌されたストリゴラクトン(SL、注3)を感知することにより種子を発芽させます。モデル植物のシロイヌナズナにおいて煙物質のカリキン(KAR、注4)を受容して種子発芽を誘導するKARRIKIN INSENSITIVE2(KAI2)のオーソログが、ストライガの発芽誘導物質の受容体であることが報告されています。ストライガには複数のKAI2タンパク質が存在しますが、SLまたはKARに対する応答性は異なります。これまで、ストライガにおけるKAI2タンパク質がSLまたはKARを選択的に認識する機構は不明でした。
東京大学大学院農学生命科学研究科の田之倉優教授の研究グループと浅見忠男教授の研究グループによる共同チームは、分子間相互作用解析によりストライガのKAI2タンパク質の一つであるShKAI2iBがKARを選択的に結合することを明らかにし、KARとの複合体構造をX線結晶構造解析法(注5)により決定しました。これにより、KARに対するリガンド選択性を規定しているShKAI2iBの構造基盤を明らかにし、ストライガのKAI2タンパク質の多様性を分子レベルで説明しました。本研究のようなKAI2オーソログと発芽誘導物質の結合様式に関する理解は、甚大な農業被害を与えている根寄生植物の発芽を制御する化合物の設計などに役立つことが期待されます。
発表内容
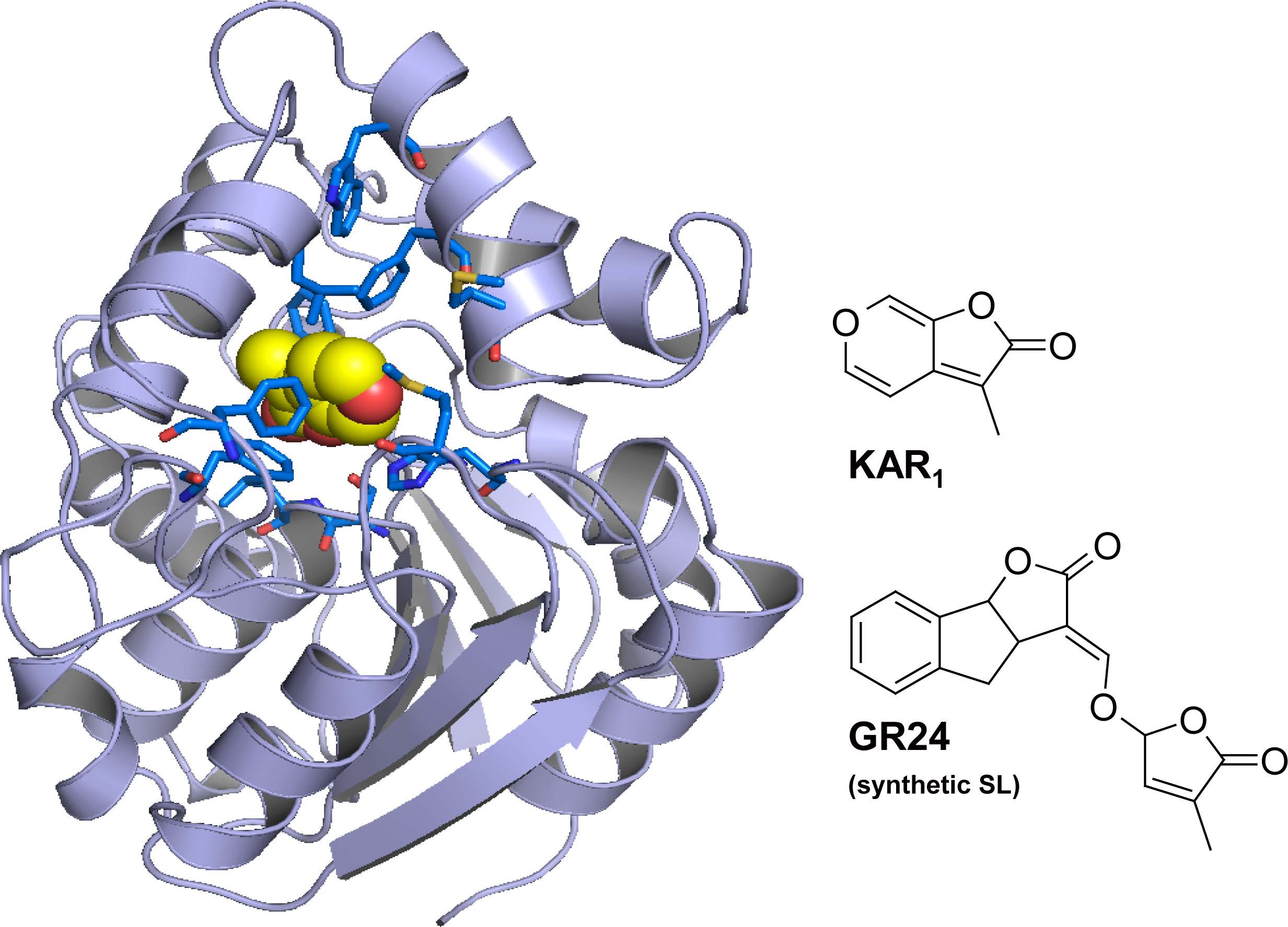
図1 KARが結合したShKAI2iBの結晶構造
ShKAI2iBは分子内部のリガンド結合ポケットにカリキン(KAR)を結合していました。KARは疎水性残基(F26, F124, F134, L142, F157, F190, I193, F194, H246等)が密集した空間に結合し、セリン残基(S95)と水分子(W)を介して水素結合(破線)を形成していました。(拡大画像↗)
「魔女の雑草」と呼ばれるストライガは、サハラ以南のアフリカに広く生息しており、ソルガム、トウモロコシ、イネなどの食糧およびバイオ燃料等の資源として重要な穀物に寄生し、甚大な被害を及ぼす根寄生植物です。ストライガ種子は直径0.2~0.5 mmで非常に小さく、休眠状態での寿命が長く、土壌中の種子を除去することは困難です。ストライガ種子は、発芽に適した環境条件下で、宿主(或いは一部の非宿主)植物の根から分泌されたシグナル物質のSLを感受して発芽します。モデル植物のイネやシロイヌナズナではSLの受容体の解析が進み、DWARF14(D14)というα/β加水分解酵素が同定されています。また、D14のパラログであるKAI2は植物を燃やした際に煙に含まれる発芽誘導物質KARの受容体として最初に同定され、最近ではSLと相互作用することやSLの分解活性をもつことが知られています。ストライガには11種類のKAI2タンパク質が存在し、KAI2遺伝子を欠失したシロイヌナズナ種子でストライガの各遺伝子を発現させた相補実験により、SLまたはKARに対する発芽応答性がKAI2タンパク質の種類により異なっていることが示されていました。しかし、ストライガにおいてKAI2タンパク質がSLまたはKARを選択的に認識する機構は不明でした。
本研究では、ストライガKAI2タンパク質のうちShKAI2iBがSLまたはKARを選択的に認識する機構の解析に取り組みました。等温滴定熱量測定(注6)とトリプトファン蛍光法(注7)を用いた相互作用解析の結果、ShKAI2iBはKARを結合することがわかりました。一方、ShKAI2iB とSLの相互作用は認められず、SLの加水分解活性も検出されなかったことから、ShKAI2iBはKARに対するリガンド選択性をもつことが明らかになりました。次にShKAI2iBとKARの複合体構造をX線結晶構造解析法により決定し、KARの結合様式を明らかにしました(図1)。KARはShKAI2iBに保存されたセリン残基と水分子を介して水素結合を形成し、この残基の変異体ではKARとの相互作用が完全に失われることがわかりました。また、KARの環構造は複数の疎水性残基に囲まれて認識されていました。
ShKAI2iB が、D14(SLに応答)及びKAI2(SLとKARに応答)とは異なり、KARを選択的に結合することが可能な構造の差異を解析するために、D14及びKAI2の立体構造とShKAI2iBの立体構造を比較しました。その結果、ShKAI2iBのリガンド結合ポケットの入口に位置するαヘリックス(αD1)の配向は、D14及びKAI2のαD1よりもリガンド結合ポケットの内側に向かってずれていました(図1)。これにより、ShKAI2iBではリガンド結合ポケットが狭くなり、KARよりも分子サイズの大きなSLを受け入れることができなくなることがわかりました。また、この構造の違いを生み出すアミノ酸残基の置換がαD1に隣接するαヘリックス(αD4)上に起こっていることを明らかにしました。さらに、ShKAI2iBとKARの複合体構造において、KARの結合様式はKAI2のそれと大きく異なっていることが観測され、この違いにもαD4上のアミノ酸残基の置換が影響していました。これらの違いはShKAI2iBとKAI2においてKARの結合様式が異なる構造基盤となると考えられます。
ストライガにおけるKAI2タンパク質の機能はまだ十分に理解されていませんが、本研究によりShKAI2iBのストライガにおける遺伝子発現レベルは乾燥時の種子で高く、SLによる発芽誘導前のコンディショニングに伴って減少することもわかりました。このことは、ShKAI2iBがストライガの種子発芽の抑制に機能していることを示唆しているかもしれません。ストライガにおけるさらなる機能解析は、多様なKAI2タンパク質による発芽調節機能の理解を深めることが期待されます。
発表雑誌
- 雑誌名
- 「Scientific Reports」
- 論文タイトル
- Structural basis of unique ligand specificity of KAI2-like protein from parasitic weed Striga hermonthica
(寄生植物ストライガ由来KAI2タンパク質のユニークなリガンド特異性の構造基盤) - 著者
- Yuqun Xu, Takuya Miyakawa, Hidemitsu Nakamura, Akira Nakamura, Yusaku Imamura, Tadao Asami and Masaru Tanokura*
- DOI番号
- 10.1038/srep31386
- 論文URL
- http://www.nature.com/articles/srep31386
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻 食品生物構造学研究室
教授 田之倉 優(たのくら まさる)
Tel:03-5841-5165
Fax:03-5841-8023
研究科HP:http://fesb.ch.a.u-tokyo.ac.jp/
用語解説
- 注1 根寄生植物
- 他の植物の根に寄生し栄養分を吸収して生育する植物です。特に、ストライガ属とオロバンキ属は主要な作物に寄生して枯らせ、アフリカや地中海沿岸地域の農業生産に甚大な被害を与えています。
- 注2 リガンド
- 特定のタンパク質(受容体と呼ばれる)に特異的に結合する物質のことです。多くの場合、リガンドは受容体の特定の部位に特異的に結合し、信号伝達の役割を担います。ホルモン、神経伝達物質、薬物などの受容体を活性化する物質が挙げられます。
- 注3 ストリゴラクトン
- ストライガの発芽誘導物質として最初に発見されたテルペノイドラクトン類の化合物です。その後、ストリゴラクトンは、菌根菌を呼び寄せるために植物の根より分泌される物質として、また植物の枝分かれを制御する植物ホルモンとして機能することが明らかになっています。
- 注4 カリキン
- 植物が燃焼した際(山火事など)の煙に含まれる発芽誘導物質です。森林が燃焼した後の植生の再生に重要と考えられています。現在、6種のカリキン類が知られています。
- 注5 X線結晶構造解析法
- 解析したいタンパク質を高純度に精製し、適した条件下で徐々に析出させていくと、分子が規則正しく並んだ結晶が形成します。この結晶にX線を照射して得られるX線回折像を解析することで、タンパク質の三次元構造を決定することができます。
- 注6 等温滴定熱量測定
- 一方の分子の溶液を標的分子に滴下した際に起こる化学反応もしくは結合反応に伴う熱変化(吸熱もしくは発熱)を観測する熱力学的方法です。この方法では、相互作用の結合定数、反応の結合比、エンタルピー変化及びエントロピー変化などの熱力学的パラメータが得られるため、よく相互作用解析に使われています。
- 注7 トリプトファン蛍光法
- タンパク質内の固有のトリプトファン残基からの内在性蛍光を利用して、タンパク質とリガンドの相互作用を解析する方法です。多くのタンパク質は、分子内部に芳香族アミノ酸、特にトリプトファンをもっているため、内在性のUV蛍光を示します。トリプトファンの最大蛍光波長や蛍光強度は周囲の環境によって変化するため、タンパク質の疎水性ポケットに埋め込まれているトリプトファンの蛍光スペクトルは、リガンドが疎水性ポケットに結合することによって変化します。