急性肺障害の悪化因子を発見
- 発表者
-
小林 幸司(東京大学大学院農学生命科学研究科 応用動物科学専攻 当時 博士課程4年)
堀上 大貴(東京大学大学院農学生命科学研究科 応用動物科学専攻 博士課程1年)
大森 啓介(東京大学大学院農学生命科学研究科 応用動物科学専攻 博士課程2年)
中村 達朗(東京大学大学院農学生命科学研究科 応用動物科学専攻 特任助教)
山崎 愛里沙(東京大学大学院農学生命科学研究科 応用動物科学専攻 修士課程2年)
前田 真吾(東京大学大学院農学生命科学研究科 応用動物科学専攻 特任助教)
村田 幸久(東京大学大学院農学生命科学研究科 応用動物科学専攻 准教授)
発表のポイント
◆急性肺障害を発生させたマウスを用いて、炎症細胞の活性には大きな影響を与えず、肺の血管透過性を上昇させて組織浮腫を引き起こし、症状を悪化させる物質を発見した。
◆肺障害を起こす原因によって、この物質の産生量と症状がともに違うことが分かった。
◆原因物質の特定とそれが引き起こす症状が明らかになり、急性肺障害の根本的な治療方法の開発や個別化医療への応用につながることが期待される。
発表概要
急性肺障害は特に高齢者に多く発症し、誤嚥や敗血症、脂肪塞栓などを原因として肺機能が低下するなどの症状がある。有効な治療方法の開発は遅れており、現在でも38.5%の患者が死に至る重篤な病気である。
これまでの研究から、さまざまな要因からくる炎症刺激により、肺上皮や血管のバリアが崩壊することで組織浮腫が起きたり、好中球などの免疫細胞が浸潤して、肺機能が低下することが明らかにされてきた。しかし、これらの病態の詳細な発症機構は明らかにされていなかった。
東京大学大学院農学生命科学研究科の村田幸久准教授と小林幸司大学院生、堀上大貴大学院生らの研究グループは、複数の炎症刺激で急性肺障害を発生させたマウスを用いて、プロスタグランジン(注1)の一種であるトロンボキサンA2 (TXA2)が肺組織中に産生されること、産生されたTXA2は血管の内皮細胞に働いて透過性を上昇させることで組織浮腫を引き起こし、急性肺障害を悪化させることを見出した。またその産生量は病因により異なることも発見した。
この物質の産生量を測定することで原因を特定し、阻害剤を用いて浮腫形成を制御することができれば、新しい急性肺障害の治療法につながることが期待される。
発表内容
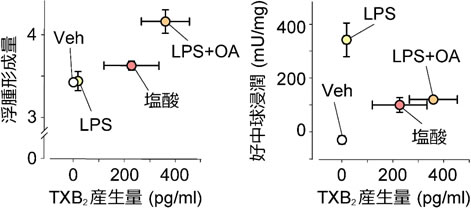
図1 溶媒投与群(Veh)や塩酸投与群、菌体外毒素(LPS)投与群、オレイン酸(LPS+OA)投与群の肺組織内の浮腫形成量と好中球浸潤、気管支肺胞内洗浄液中のTXA2代謝物(TXB2)量を比べた。すると浮腫形成量とTXB2産生量は正の相関関係にあったが(左)、好中球浸潤量とTXB2産生量にはそれが見られなかった(右)。(拡大画像↗)
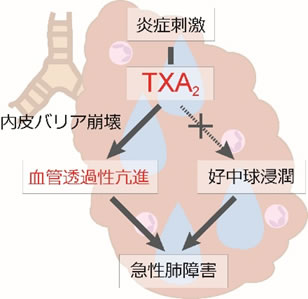
図2 さまざまな炎症刺激により肺上皮から産生されたTXA2は内皮バリア崩壊を介して血管透過性を亢進させて浮腫形成を引き起こし、結果として急性肺障害を悪化させることが分かった。(拡大画像↗)
<研究の背景>
急性肺障害は胃の内容物の誤嚥や敗血症、脂肪塞栓などさまざまな原因で起こり、急速に進行する呼吸器障害の総称である。その特徴として肺組織の好中球浸潤や浮腫形成と、それに伴う呼吸機能の低下が挙げられるが、その病態は原因によって異なる。この病気は特に高齢者で多く発症し、致死率が現在でも38.5%と非常に高く重篤な病気である。しかし現在有効な治療法は存在しない。
トロンボキサンA2(TXA2)は細胞膜由来のアラキドン酸からシクロオキシゲナーゼやトロンボキサン合成酵素によって産生されるプロスタグランジンの一つで、TP受容体を介してその作用を発揮する。急性肺障害を起こした肺組織中でも高濃度のTXA2が検出されることが知られているが、どのような刺激に対してどこからTXA2が産生され、産生されたTXA2が病態にどのような影響を与えるかは分かっていなかった。
<研究内容>
① TP受容体阻害は塩酸投与による急性肺障害を改善する。
マウスに塩酸を気管内投与すると6時間後に、肺機能の低下(血中酸素飽和度の低下)が確認された。TP受容体の阻害薬を前処置すると、この症状は改善した。組織切片の観察において、塩酸処置肺では好中球浸潤や滲出液漏出が観察された。TP受容体阻害薬の前処置は、滲出液漏出を抑制したが、好中球浸潤には影響しなかった。
組織の水分含有量とミエロペルオキシダーゼ(MPO)活性を測定して、それぞれ肺浮腫と好中球の浸潤の程度を評価した。塩酸処置は肺浮腫と好中球の浸潤を引き起こしたが、TP受容体阻害は好中球浸潤には影響せず、浮腫のみ有意に抑制することが分かった。
② 肺浮腫の程度はTXA2産生量に比例して増加する。
塩酸投与(誤嚥性肺障害)モデルと菌体外毒素LPS投与(敗血症)モデル、オレイン酸投与(LPS+OA、脂肪塞栓)モデルの3つの急性肺障害モデルを比較した。気管支肺胞内洗浄液中のTXB2(TXA2代謝産物)量を測定したところ、LPS+OAモデル、塩酸モデルの順に高く、LPSモデルではほぼ検出されなかった。このTXB2(TXA2)産生量は各モデルにおける浮腫の程度と正の相関を示した。一方で、好中球の浸潤程度とは相関がみられなかった(図1)。
さらに、TP受容体阻害もしくはTXA2合成酵素の阻害は塩酸やLPS+OAによる肺浮腫を改善して治療効果を示したが、好中球浸潤のみが起こるLPSモデルには効果を示さなかった。免疫染色を行ったところ、障害を受けた肺の上皮細胞にTXA2合成酵素の発現が観察された。
③ TP受容体刺激は内皮バリアを崩壊させて血管透過性を亢進させる。
浮腫は組織血管の透過性亢進が原因で起こる。TP受容体作動薬をマウス耳介に塗布して色素を静脈内投与したところ、色素の漏出が起こり、血管透過性が上昇していることが分かった。
血管透過性は、血管の内側にある一層の内皮細胞の細胞間接着によって規定され、これは接着分子VE-カドヘリンによって仲介されている。マウス耳介の免疫染色を行ったところ、TP受容体刺激はVE-カドヘリンの連続的な局在を乱し、内皮バリアを崩壊させた。単離内皮細胞においてもTP受容体刺激は内皮バリアを崩壊させ、この崩壊は、Ca2+チャネルやRhoキナーゼの阻害により抑えられることが分かった。
<考察・社会的意義>
急性肺障害において上皮から産生されたTXA2は内皮細胞のTP受容体を刺激し、細胞内Ca2+濃度の上昇やRhoキナーゼの活性化を介してバリアを崩壊させ、浮腫を形成することが分かった(図2)。TP受容体やTXA2合成酵素の阻害は急性肺障害の治療に有効であるが、その病因によりTXA2の産生量が違い、治療に対する感受性が異なることが明らかになった。
急性肺障害に対する治療法は現在存在しない。本研究は、個体レベルの実験によってTXA2の急性肺障害にあたえる影響とその機構を明らかにするとともに、その治療応用の可能性を示した初めての報告である。病因によってTXA2の産生量と病態、治療反応性に差があることを発見した点は、個別化医療への応用など、実用という点においても非常に有用な発見である。
発表雑誌
- 雑誌名
- 「Scientific Reports」
- 論文タイトル
- Thromboxane A2 exacerbates acute lung injury via promoting edema formation
- 著者
- Koji Kobayashi, Daiki Horikami, Keisuke Omori, Tatsuro Nakamura, Arisa Yamazaki, Shingo Maeda, Takahisa Murata
- DOI番号
- 10.1038/srep32109
- 論文URL
- http://www.nature.com/articles/srep32109
問い合わせ先
東京大学大学院農学生命科学研究科 応用動物科学専攻 放射線動物科学教室
准教授 村田 幸久(むらた たかひさ)
Tel:03-5841-7247
Fax:03-5841-8183
研究室URL:http://www.vm.a.u-tokyo.ac.jp/houshasen/index.html
用語解説
- 注1 プロスタグランジン(PG)
- 細胞膜の脂質から産生される生理活性物質。炎症反応の主体をなす。主なものとしてPGE2、PGI2、PGF2、 PGD2、TXA2などがある。