世界初! 冷凍・冷蔵不要で簡易・迅速・超高感度・安価な遺伝子診断技術を開発
―ファイトプラズマユニバーサル診断キット―
- 発表者
-
宮﨑 彰雄(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 博士課程1年)
前島 健作(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 助教)
山次 康幸(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 准教授)
難波 成任(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 教授)
発表のポイント
◆40種以上のあらゆるファイトプラズマ(注1)を網羅的に検出できる「ファイトプラズマユニバーサル検出キット」(注2)の乾燥試薬キットを世界に先駆け開発しました。
◆試薬・酵素の保存性を飛躍的に向上させたLAMP法(注3)による超高感度・迅速・簡易・安価な遺伝子診断乾燥試薬キットです。
◆温度など環境条件を気にせず輸送・保管ができるため、これまで冷凍・冷蔵による試薬の輸送・保管が困難であった世界中のあらゆる途上国に提供・利用が可能で、未知の系統や媒介昆虫の解明なども含め、あらゆるファイトプラズマ病の確実な根絶体制を可能にしました。
発表概要

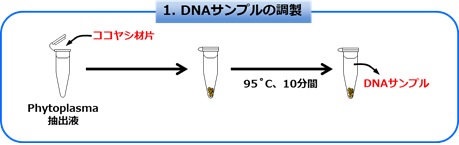
【図1】「ファイトプラズマユニバーサル検出キット」の乾燥試薬キット
従来キットと同様に、検査に必要な試薬を全て備えたキットとして提供。
上段:ファイトプラズマ検出用乾燥試薬(1検体ごとに分注してあり、1年間性能保持可能)。
下段:左から順に、抽出液、試薬溶解液、ミネラルオイル、陽性コントロール、陽性コントロール溶解液、陰性コントロール。
ファイトプラズマ検出用乾燥試薬と陽性コントロールを乾燥化したことにより、過酷な温度環境下においても、冷凍保存された「ファイトプラズマユニバーサル検出キット」と同一の性能を保持可能。)
(拡大画像↗)
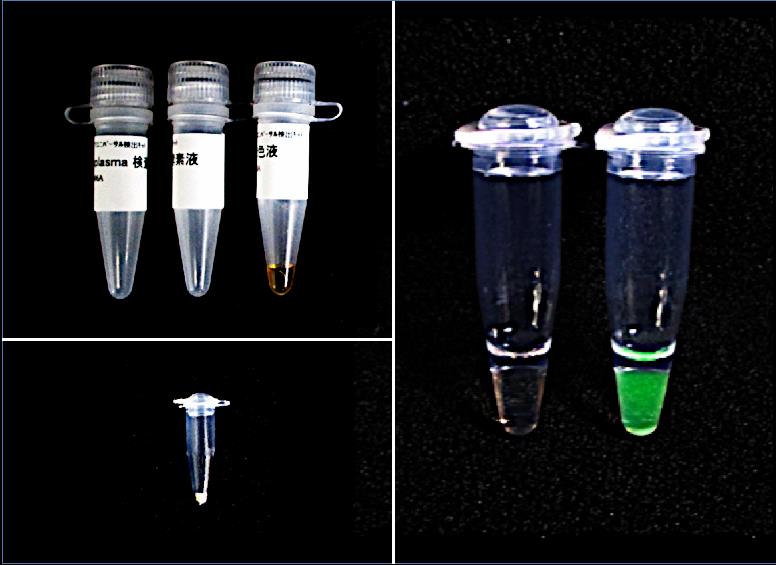
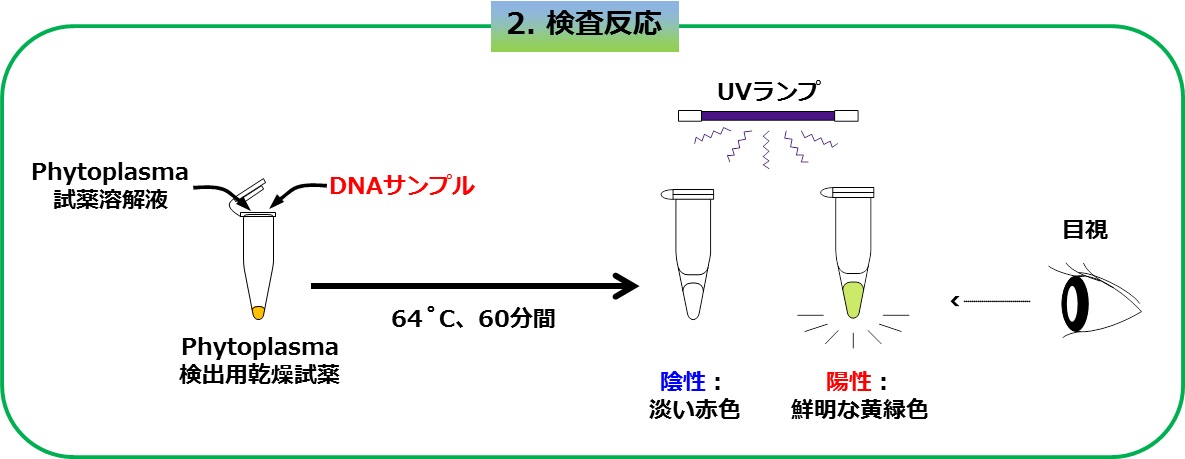
【図2】従来キットとの乾燥試薬キットの比較
左上: 3本のチューブは、従来キットのファイトプラズマ検査液、酵素液、蛍光発色液であり、検出反応の最重要パーツであるが、冷凍保管が必須。
左下 : 本研究成果により、従来キットのパーツを1本にまとめた乾燥試薬。この状態で、1年間、性能を保持することが可能。
右 : 反応後、紫外線ランプを照射したもの。従来のキットと同様に、反応液の蛍光発色(緑色)によって目視判定できる。(左: 健全、右: ファイトプラズマに感染) (拡大画像↗)
東京大学植物病院は株式会社ニッポンジーン マテリアルとの共同研究により、2016年に東京大学植物病院により実用化された「ファイトプラズマユニバーサル検出キット」の乾燥キット化(図1)に成功しました。
「ファイトプラズマユニバーサル検出キット」は、お湯を入れた魔法瓶を用いるだけで40種以上のファイトプラズマを網羅的に検出できる画期的なキットとして開発・製品化されましたが、一般的な遺伝子工学試薬と同様に、冷凍ないし冷蔵での輸送・保管が必要です。しかし、特にファイトプラズマ病の被害が深刻化している地域では、試薬の輸送のみならず、保管や実際の使用現場において、冷凍・冷蔵設備の不備や頻繁な停電などにより、高温や日射などに伴う過酷な温度変化が想定され、試薬の性能低下を免れません。このため、途上国における近年の気候変動などによるファイトプラズマ病の多発や、熱帯・亜熱帯地域での食糧・バイオエタノール生産に生じている甚大な被害に対応するため、乾燥試薬開発が喫緊の課題でした。
本研究では、冷凍保管が必須であった試薬の乾燥試薬化技術を開発し(図2)、製品化されている「ファイトプラズマユニバーサル検出キット」のこれまでの性能を保持したままで、感度などの性能が劣化しない乾燥試薬キット化に世界で初めて成功しました。本技術により、世界中の熱帯や亜熱帯地域のみならず、先進国にも安価な輸送経費により検出キットを提供し、何時でも何処でも誰でも容易に現場で先端技術を用いた検査を行うことができます。
今後、ファイトプラズマ病のみならずあらゆる植物病の診断に利用できる技術であり、とくに途上国の安定な農業生産および環境保全に大きく貢献します。
なお、本共同研究は富山県の平成28年度産学官連携推進事業【先端技術実用化支援枠】の補助を受けて東京大学とニッポンジーン マテリアルにより行われました。
発表内容
ファイトプラズマは1,000種類以上の植物に感染し甚大な被害をもたらしますが、治療方法が確立されていないため、感染植物を早期に発見し処分することが唯一の根絶策です。開発途上国では近年、イネ、ムギ、トウモロコシ、ココヤシ (ココナッツ)、バナナ、キャッサバ、サトウキビ等の重要作物のほか、野菜、花き、果樹 (ブドウ、モモ、リンゴなど)、樹木 (キリ、クワ、ナツメ、ホルトノキなど) に対して甚大な被害を生じていることが明らかになってきました。特にパプアニューギニアなど赤道地帯の農業地域では、ヤシなどが枯死し全滅する被害が急速に拡大しています。しかしながら、症状が進行しないと見た目では感染の有無が判断できず、発見された時には手遅れとなるため、高感度かつ現地での使用が可能な簡便な検査方法が求められていました。
このため2016年に東京大学植物病院はLAMP法を用いて「ファイトプラズマユニバーサル検出キット」を開発、実用化しました。ファイトプラズマは遺伝的多様性が高く、9グループ40種以上に分類されており、種ごとにプライマーを設計して「感染組織からのDNA精製・PCR増幅反応・電気泳動」により検出するのが、これまでは一般的でした。また、共通プライマーによる全グループのPCR増幅法はありますが、非特異反応が出るため、制限酵素による切断後の電気泳動や塩基配列決定に基づく解析が必要でした。
「ファイトプラズマユニバーサル検出キット」は蛍光の有無により確実にファイトプラズマか否かを判断できる画期的な技術です。しかし、キットを現地に提供するにあたり、最大の課題は輸送と保管でした。一般的に遺伝子工学試薬は冷凍ないし冷蔵での輸送・保管が管理上望ましいことが多く、LAMP法においてもそれは例外ではありません。しかしながら、海外、特にアジアやアフリカに輸出するためにはドライアイス梱包を受け入れる運送業者が少なく、パプアニューギニアをはじめとするオセアニアや東南アジア諸国に向け物資を輸送する運送会社では、受け入れる業者そのものが存在しないのが現状です。さらに、これらの国々においては輸送時の温度上昇や、一部の地域においては不安定な電力供給による突発的あるいは計画的な停電がしばしば発生します。このような過酷な環境温度の変化などは、試薬に大きな負荷を与え性能劣化をもたらし、キットを必要とする地域へ供給するうえでの大きな障害となっていました。
試薬の性能を保持するためには、凍結融解をくり返さず、温度変化に影響されない安定な試薬の形態が不可欠です。そこで、試薬の乾燥による保管に注目し、さまざまな添加物や乾燥技術を検討し、長期間の輸送・保管でも性能が劣化しない試薬乾燥技術の開発に成功しました。
今回開発された乾燥キットは、「ファイトプラズマユニバーサル検出キット」と同一の性能を保持したまま、室温 (20-25˚C) で1年間、その性能を維持できます。また、高温下 (45˚C) においても90日間、性能を保持できます。さらに、検査試薬を1テスト分毎に小分けして乾燥化しているため、乾燥試薬にDNAサンプルと試薬溶解液を添加するだけで、「ファイトプラズマユニバーサル検出キット」と同じ遺伝子診断が可能です。このため、どのような地域、場所においても簡単に検査溶液を準備することができ、高度な知識や経験を必要とせずに効率的に検査が行えるという、利便性の向上も実現しました。
発表
本キット開発の成果は、2017年2月11日(土)に開催されるLAMP研究会にてニッポンジーン マテリアルよりパプアニューギニアにおけるキットの社会実装試験を委託した一般社団法人太平洋農業アライアンスの志柿俊朗氏によりその技術成果が発表され、近々販売される予定です。
問い合わせ先
東京大学大学院農学生命科学研究科 生産・環境生物学専攻
植物病理学研究室・植物医科学研究室・植物病院
教授 難波 成任(なんば しげとう)
Tel:03-5841-5053
Fax:03-5841-5054
E-mail:anamba[at]mail.ecc.u-tokyo.ac.jp ( [at]を@に変えてください。)
HP:http://park.itc.u-tokyo.ac.jp/ae-b/planpath/index.html
用語解説
- 注1.ファイトプラズマ
- イネなど重要作物、野菜、花き、樹木などを枯らし農業生産上甚大な被害をもたらす植物病の病原です。1,000種以上の植物に感染し、感染した植物は黄化病や萎縮病、天狗巣病、(花の) 葉化病など特徴的な症状を発症し、最終的には枯死します。1967年にマイコプラズマ様微生物 (mycoplasma-like organism, MLO) として世界に先駆け日本で発見された植物病原微小細菌群です。その後の研究により、ファイトプラズマと正式に命名されるとともにPhytoplasma属細菌として再分類されました。2004年に全ゲノム解読され、病原性遺伝子「TENGU」や「ファイロジェン」などが次々に発見されました。
- 注2.「ファイトプラズマユニバーサル検出キット」
- 東京大学 植物病院により、2016年に実用化。40種以上からなるファイトプラズマを網羅的に検出することができます。
- 注3.LAMP法 (Loop-mediated Isothermal Amplification)
- 定温遺伝子増幅法の一つとして、日本で開発された世界独占特許の新規遺伝子増幅法です。遺伝子を増幅させる際にPCR法のように反応液の温度を何度も繰り返して昇降させる必要がなく、一定温度で反応を行うDNA増幅法です。そのため、PCRよりも反応の迅速性に優れ、サーマルサイクラーのような高価な機器を必要としません。近年、国内外で現場等での病原体の迅速な検出・診断手法として利用が進んでいます。