脂質代謝を調節する転写因子SREBPの活性化を熱ショックタンパク質90が厳密に制御する新たな機構の発見
- 発表者
-
官 彦州 (東京大学大学院農学生命科学研究科・博士課程)
橋詰 力 (東京大学大学院高齢社会総合研究機構・特任助教)
柴田貴広 (名古屋大学大学院生命農学研究科・准教授)
内田浩二 (名古屋大学大学院生命農学研究科・教授:当時)
清水 誠 (東京大学大学院農学生命科学研究科・助教)
井上 順 (東京大学大学院農学生命科学研究科・准教授)
佐藤隆一郎(東京大学大学院農学生命科学研究科・教授)
発表のポイント
◆コレステロール・脂肪酸代謝を制御する転写因子SREBP(注1)の活性化の新たな機構を発見しました。
◆熱ショックタンパク質HSP90(注2)がSREBP/SCAP複合体に結合し、その安定性を制御し、脂質代謝制御に関与する ことがわかりました。
◆新たな因子の発見により脂質代謝制御機構の詳細が明らかになり、代謝改善に向けた治療薬・機能性食品開発の新 たな展開が期待されます。
発表概要
転写因子SREBPはコレステロール・脂肪酸代謝に関与する酵素遺伝子の発現を正に制御します。SREBPは小胞体膜タンパク質として合成されたのちに、SCAP(注3)と複合体を形成し、細胞内のコレステロール量、不飽和脂肪酸量などを感知するセンシング機構により、ゴルジ装置まで輸送され、活性型へと切断されます。この細胞内の輸送・活性化機構は、ヴォート生化学/マッキー生化学などの教科書でも図解入りで説明される、細胞内で生じる代謝制御機構の代表例とも言えます。
今回、東京大学大学院農学生命科学研究科の佐藤隆一郎教授のグループは、SCAPに結合する新規の細胞内タンパク質としてHSP90を見出し、HSP90が重要な働きをすることを発見しました。SREBP/SCAP複合体は、複合体を形成することにより互いの安定性を増加させ、小胞体からゴルジへ輸送されると考えられてきましたが、今回の発見から、さらにHSP90が加わった3量体として細胞内輸送されること、それぞれの安定性が維持されることが明らかになりました。
発表内容
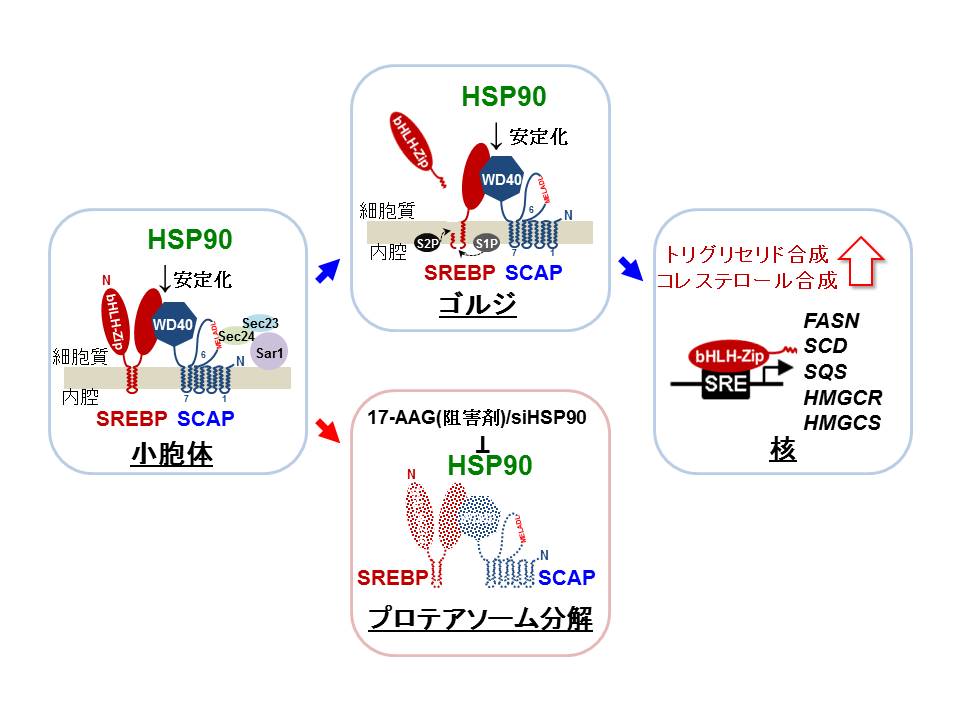
【図1】HSP90結合によるSREBP/SCAP複合体の安定化と脂質合成亢進機構
(拡大画像↗)
転写因子SREBPは小胞体膜上で結合タンパク質SCAPと2量体を形成します(図1)。この複合体はゴルジ装置まで輸送され、2種類の切断酵素(S1PとS2P)によるプロセシングを受けた後に、N末端側の活性型SREBPが核へと移行し、核内で転写因子として種々の応答遺伝子の転写をスイッチオンします。SREBPのC末端領域とSCAPのC末端領域が直接結合することが知られています。SCAPのC末端領域はWDリピート配列(注4)を有しており、この配列を介してSREBPと結合します。WDリピート配列は種々のタンパク質-タンパク質結合に関与することから、我々はSCAPにはSREBP以外の結合タンパク質が存在する可能性を想定しました。そこでSCAPのC末端領域を培養細胞内に過剰発現させ、これと結合するタンパク質を回収し、質量分析法を用いてそれらタンパク質の同定を試みました。高頻度で回収されたタンパク質のフラグメントはHSP90でした。
複数の分子細胞生物学的解析により、細胞内でSREBP/SCAP/HSP90複合体の形成を確認しました。そこでHSP90活性を抑制する阻害剤17-AGGを含む培地で細胞を培養すると、時間依存的にSCAP、SREBPが 速やかに分解することが見出されました。同様の現象はsiRNAを用いて内因性のHSP90発現を抑制することによっても確認されました。その結果、SREBPの応答遺伝子発現は低下し、細胞内のコレステロール/トリグリセリド量は減少しました。マウスに17-AAGの誘導体17-DMAGを投与すると、肝臓でのコレステロール・脂肪酸合成に関与する遺伝子の発現は低下し、その結果、肝細胞内のコレステロール/トリグリセリド蓄積量も減少しました。以上の事実はSREBPを介した脂質代謝制御機構にHSP90が深く関与することを示しており、脂質代謝を改善する治療薬・機能性食品開発の新たな標的となり得ることを示唆しています。
またガン細胞は増殖活性が高く、脂質合成も盛んです。ある種のガンではHSP90発現が高いことが知られており、HSP90は抗ガン治療の標的の一つです。今回の知見は、この事実をよく説明しています。HSP90発現・活性を低下させることは、脂質合成を亢進させ増殖活性を高く維持するガン細胞の増殖を抑えることに結びつくことが期待されます。
この研究は、日本学術振興会科研費基盤(S)、内閣府戦略的イノベーション創造プログラム(SIP)、AMED-CREST、飯島藤十郎記念食品科学振興財団の支援を受けて行われました。
発表雑誌
- 雑誌名
- 「Journal of Biological Chemistry」
- 論文タイトル
- :Heat Shock Protein 90 Modulates Lipid Homeostasis by Regulating the Stability and Function of Sterol Regulatory Element-Binding Protein (SREBP) and SREBP Cleavage-Activating Protein
- 著者
- Yen-Chou Kuan, Tsutomu Hashidume, Takahiro Shibata, Koji Uchida, Makoto Shimizu, Jun Inoue and Ryuichiro Sato
- DOI番号
- 10.1074/jbc.M116.767277
- 論文URL
- http://www.jbc.org/content/292/7/3016.abstract.html
問い合わせ先
東京大学大学院農学生命科学研究科 応用生命化学専攻
食品生化学/栄養・生命科学研究室
教授 佐藤 隆一郎(さとう りゅういちろう)
Tel:03-5841-5136
Fax:03-5841-8029
E-mail: aroysato<アット>mail.ecc.u-tokyo.ac.jp
<アット>を@に変えてください。
用語解説
- 注1.SREBP
- コレステロール代謝関連遺伝子の発現を主に制御するSREBP-2と脂肪酸代謝関連遺伝子の発現を調節するSREBP-1が存在する。いずれも2回の膜貫通領域を持ち、合成後、小胞体膜上に膜タンパク質として局在する。
- 注2.熱ショックタンパク質HSP90
- タンパク質のフォールディングを制御する分子シャペロンとしての機能を持ち、複数のHSPファミリーメンバーの1つでおよそ90kDaの分子量を持つ分子。これまでに200以上のタンパク質との結合が報告されている。
- 注3.SCAP
- 8回膜貫通領域を持つSREBP結合タンパク質。SREBPのC末端領域とSCAPのC末端領域が結合し、2量体を小胞体膜上で形成する。細胞内のコレステロール量が低下した条件などに呼応して複合体はゴルジ装置へと輸送され、そこで切断を受け、SREBPのN末端領域が活性型転写因子として核へ移行する。
- 注4.WDリピート
- トリプトファン-アスパラギン酸(WD)で終わる約40アミノ酸のモチーフが 4回以上くり返し存在する配列と定義される。通常WDリピートはβプロペラ構造を形成して,タンパク質が相互作用する場として機能している。SCAPは8回の繰り返し配列がβプロペラ構造を形成すると考えられている。