新規な糖質加水分解酵素「エンド-β-1,2-グルカナーゼ」の同定と機能構造解析
- 発表者
- 阿部 紘一(東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程学生)
中島 将博(東京理科大学理工学部応用生物科学科 助教)
山下 哲郎(岩手大学農学部応用生物化学科 准教授)
松永 大輝(東京理科大学大学院理工学研究科応用生物科学専攻 大学院生;当時)
紙透 伸治(麻布大学獣医学部獣医学科 講師)
仁平 高則(新潟大学大学院自然科学研究科 食品製造学研究室 特任助教)
高橋 侑汰(新潟大学農学部 修士課程学生)
杉本 直久(新潟大学農学部 博士研究員;当時)
宮永 顕正(東京工業大学理学院 助教)
中井 博之(新潟大学農学部 応用生物化学科 准教授)
荒川 孝俊(東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
伏信 進矢(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
田口 速男(東京理科大学理工学部応用生物科学科 教授)
発表のポイント
◆新規な糖質加水分解酵素(注1)エンド-β-1,2-グルカナーゼを同定し、その機能と構造を明らかにしました。
◆エンド-β-1,2-グルカナーゼのアミノ酸配列を初めて明らかにし、これが既知の酵素とは全く異なることを示しました。
◆さらなるβ-1,2-グルカン関連酵素の発見やエンド-β-1,2-グルカナーゼを用いた新規な糖質の調製に大きく貢献することが期待されます。
発表概要
β-1,2-グルカンはデンプンやセルロースと同じくグルコースから構成される多糖です。しかし、この多糖は入手困難であるためにその代謝に関わる酵素・タンパク質の研究例は非常に少ないのが現状です。その中でもβ-1,2-グルカンをエンド様式(注2)で加水分解するエンド-β-1,2-グルカナーゼは今から約30年前に発見された酵素ですが、アミノ酸配列および詳細な機能は不明でした。
東京理科大学理工学部応用生物科学科の中島将博助教らの研究グループはβ-1,2-グルカンを合成・分解する酵素に着目して研究を行ってきました。今回、東京大学大学院農学生命科学研究科の阿部紘一博士課程学生、同研究科の伏信進矢教授らの研究グループは、中島助教らのグループと共同で研究を行い、細菌由来のエンド-β-1,2-グルカナーゼを世界で初めて同定し、さらにその機能・立体構造も明らかにしました。
本研究は、他のβ-1,2-グルカン関連酵素の探索やエンド-β-1,2-グルカナーゼを用いた糖鎖の調製を行う上で重要な情報をもたらすと考えられます。
発表内容
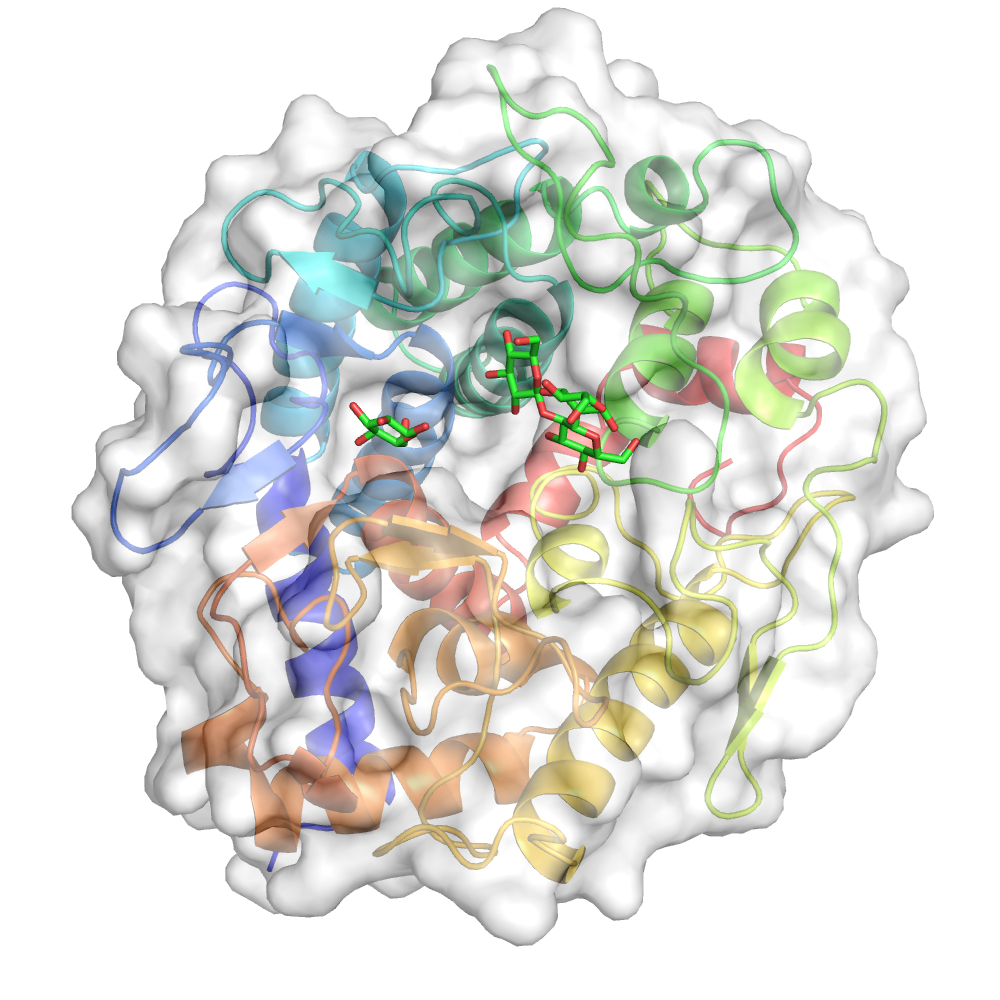
【図1】 エンド-β-1,2-グルカナーゼの立体構造
グルコースとソホロトリオース(三糖)が分子の中央に結合している。 (拡大画像↗)
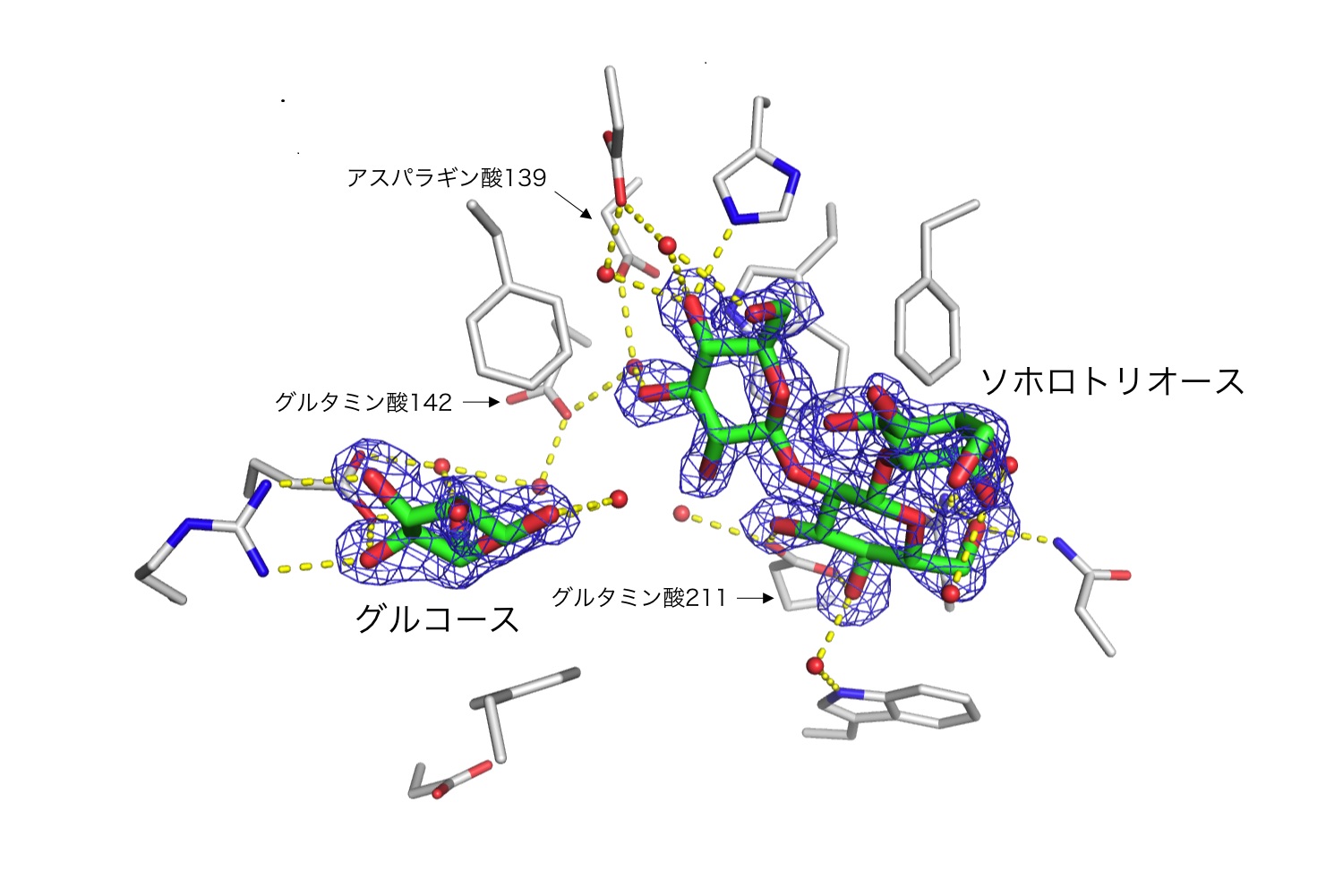
【図2】活性部位の構造
活性に重要な酸性アミノ酸を矢印で示した。 (拡大画像↗)
β-1,2-グルカンはグルコースがβ-1,2-結合という珍しい結合様式で連なった多糖であり、環状構造のものがよく研究されています。環状β-1,2-グルカンは根粒菌やBrucella属の細菌が生産し、人などの宿主への感染や浸透圧の調節に利用することで知られています。また、環状β-1,2-グルカンは疎水性の化合物と複合体を形成し、その化合物の溶解度を上げるなどの性質があることから薬学、食品産業においても興味が持たれています。しかし、β-1,2-グルカンはデンプンやセルロースなどとは異なり入手困難であるため、この多糖の代謝・輸送に関わるタンパク質の研究はほとんど進んでいませんでした。特に、β-1,2-グルカンをエンド様式で加水分解し、β-1,2-グルカンよりも短鎖のソホロオリゴ糖を生成するエンド-β-1,2-グルカナーゼは、約30年前に活性が報告され、部分精製されたものの、そのアミノ酸配列は未知でした。
東京理科大学理工学部応用生物科学科の中島将博助教らの研究グループは、以前よりβ-1,2-グルカンを合成・分解する酵素に着目して研究を行ってきました。近年、同研究グループはβ-1,2-グルカンを合成できる酵素(1,2-β-オリゴグルカンホスホリラーゼ)を利用し、直鎖状のβ-1,2-グルカンを大量調製することに成功しました。これによりエンド-β-1,2-グルカナーゼの研究が容易になりました。
〈研究の内容・意義〉
今回の研究では、はじめに、エンド-β-1,2-グルカナーゼを活性既知の細菌Chitinophaga arvensicolaから精製し、その内部配列をもとに類縁種Chitinophaga pinensisからエンド-β-1,2-グルカナーゼのアミノ酸配列を同定しました。エンド-β-1,2-グルカナーゼのアミノ酸配列はこれまでに知られている糖質加水分解酵素とは全く異なっていたことから、新しい糖質加水分解酵素のファミリー番号(144番)が付与されました。また、生化学的な解析によりエンド-β-1,2-グルカナーゼは五糖以上のβ-1,2-グルカンに特異的であること、反応機構は立体反転型(注3)であること、およびソホロヘプタオース(七糖)を切断する際に主に非還元末端から四糖を遊離することを明らかにしました。
さらに、エンド-β-1,2-グルカナーゼとソホロトリオース(三糖)とグルコースとの複合体構造をX線結晶構造解析(注4)により明らかにしました。エンド-β-1,2-グルカナーゼの全体構造は一部の糖質加水分解酵素と少し似ていましたが、活性中心は大きく異なっており、β-1,2-グルカンを捉えるのに適したクレフト状の構造を有していました。また、活性中心の構造から、触媒残基の候補となる六つの酸性アミノ酸の存在が明らかとなりました。これらの酸性アミノ酸残基に関して点変異体(注5)による解析を行ったところ、そのうち3つの酸性アミノ酸残基(アスパラギン酸139、グルタミン酸142、グルタミン酸211)が酵素活性に重要であることが明らかとなりました。
〈今後の予定・期待〉
β-1,2-グルカン関連タンパク質に関する知見はまだまだ少ないですが、本研究は他の新たなβ-1,2-グルカンの代謝・輸送に関わるタンパク質の発見につながることが期待されます。また、β-1,2-グルカンにエンド-β-1,2-グルカナーゼを作用させることで、ソホロオリゴ糖を容易に調製することが可能となりました。ソホロオリゴ糖はβ-1,2-グルカンよりも希少で、その機能はほとんど知られていません。今回決定した立体構造は、エンド-β-1,2-グルカナーゼを利用する上でも重要な基礎的情報になります。
発表雑誌
- 雑誌名
- :「The Journal of Biological Chemistry」(掲載日:2017年3月7日)
- 論文タイトル
- :Biochemical and structural analyses of a bacterial endo-β-1,2-glucanase reveal a new glycoside hydrolase family
- 著者
- :Koichi Abe, Masahiro Nakajima, Tetsuro Yamashita, Hiroki Matsunaga, Shinji Kamisuki,
Yuta Takahashi, Naohisa Sugimoto, Akimasa Miyanaga, Hiroyuki Nakai, Takatoshi Arakawa,
Shinya Fushinobu, Hayao Taguchi - DOI番号
- :10.1074/jbc.M116.762724
- 論文URL
- : http://www.jbc.org/content/early/2017/03/07/jbc.M116.762724
問い合わせ先
教授 伏信 進矢(ふしのぶ しんや)
Tel:03-5841-5151
Fax:03-5841-5151
研究室URL: http://enzyme13.bt.a.u-tokyo.ac.jp/
用語解説
- 注1.糖質加水分解酵素
- アミラーゼ、セルラーゼなど、糖質のグリコシド結合に作用して加水分解する酵素の総称でGlycoside Hydrolaseと呼ばれる。フランスのHenrissatらによりファミリー分類がなされており(http://www.cazy.org/)、Glycoside Hydrolaseのファミリーは2017年3月13日現在1番から136番まで知られている。
- 注2.エンド様式
- 糖質加水分解酵素はその分解様式に基づき、エンド型とエキソ型に分けられる。エンド型酵素は糖のグリコシド結合の内部を切断し、エキソ型酵素は糖のグリコシド結合の末端から切断する。
- 注3.立体反転型
- 糖質加水分解酵素の反応機構の一つで、基質と生成物のアノマーが逆になる(α結合→βアノマーもしくはβ結合→αアノマー)機構のことを言う。
- 注4.X線結晶構造解析
- 酵素を含むタンパク質の立体構造を明らかにするための最も一般的な方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることができる。
- 注5.点変異体
- 酵素の特定のアミノ酸残基を別のアミノ酸残基に置換したもの。目的の残基に変異を入れることで酵素の活性が変われば、その残基の役割を推定できる。