ビフィズス菌が腸内の糖鎖を分解する酵素の構造を解明
- 発表者
-
佐藤 真与 (東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程学生)
Dorothee Liebschner (高エネルギー加速器研究機構物質構造科学研究所 博士研究員;当時)
山田 悠介 (高エネルギー加速器研究機構物質構造科学研究所 助教)
松垣 直宏 (高エネルギー加速器研究機構物質構造科学研究所 准教授)
荒川 孝俊 (東京大学大学院農学生命科学研究科応用生命工学専攻 助教)
Siobhán S. Wills (University of Western Australia 大学院生)
Mitchell Hattie (University of Western Australia 大学院生)
Keith A. Stubbs (University of Western Australia 准教授)
伊藤 佑 (東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程学生;当時)
千田 俊哉 (高エネルギー加速器研究機構物質構造科学研究所 教授)
芦田 久 (近畿大学生物理工学部食品安全工学科 教授) 伏信 進矢 (東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
発表のポイント
◆ビフィズス菌がヒトの腸内で糖鎖を分解して定着・増殖するのに関わる酵素の立体構造と機能を明らかにしました。
◆α-N-アセチルガラクトサミニダーゼという酵素の構造を、高性能の実験施設を利用して決定し、そのユニークな分子機構を明らかにしました。
◆ヒトとビフィズス菌が共生を通じて進化をとげた様子の一端が明らかとなり、今後のヒトと腸内細菌に関する研究において重要な知見を提供しました。
発表概要
ビフィズス菌(注1)は「健康によい」腸内細菌(善玉菌)としてよく知られています。ビフィズス菌は特に乳児の腸内に多く生息しており、ヒトの母乳に含まれるオリゴ糖をエネルギー源として生育に利用し、母乳栄養児の腸内に定着・増殖することが分かっています。一方で、ヒトの腸管粘膜に存在する糖タンパク質(ムチン)(注2)の糖鎖も、ビフィズス菌に利用されていることが明らかになってきました。
近畿大学生物理工学部の芦田久教授らのグループは、ビフィズス菌がムチンの糖鎖を分解するときに重要な役割をはたす新規な酵素として、「α-N-アセチルガラクトサミニダーゼ(NagBb)」を2012年に発見しました。今回、東京大学大学院農学生命科学研究科の佐藤真与博士課程学生、荒川孝俊助教、伏信進矢教授らの研究グループは、芦田教授らと共同で研究を行い、α-N-アセチルガラクトサミニダーゼの立体構造を世界で初めて明らかにしました。立体構造の決定においては、高エネルギー加速器研究機構物質構造科学研究所の千田俊哉教授らのグループと共同で研究を行い、同研究所が設計・開発した高性能の実験施設を利用して、酵素を構成するアミノ酸に含まれる硫黄原子を手がかりとする手法が用いられました。
本研究は、ビフィズス菌がヒトと共生する過程でユニークな酵素を進化させてきたことを示唆するものであり、ビフィズス菌が腸内の糖鎖を利用して定着・増殖する仕組みがより明確になっただけでなく、新たなビフィズス菌増殖因子(プレバイオティクス)(注3)の開発にもつながることが期待されます。
発表内容
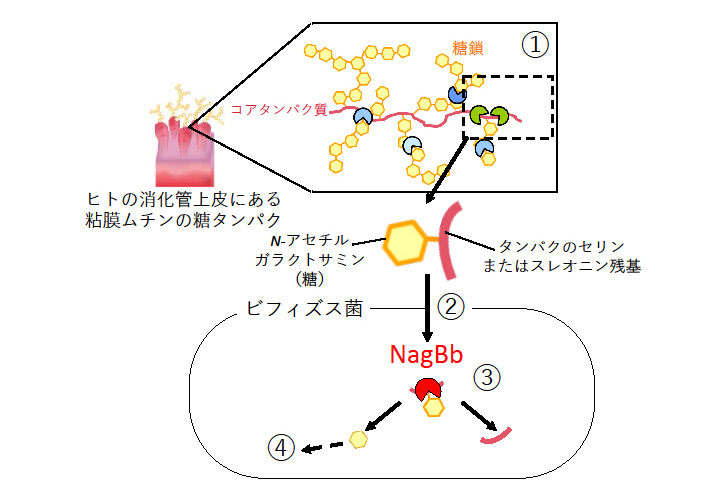
図1 ビフィズス菌がヒトの腸内粘膜の糖タンパク質(ムチン)を利用する仕組み
①ビフィズス菌が菌体外に放出した様々な酵素によって、糖鎖やタンパクが分解される ②ビフィズス菌がその断片(糖であるN-アセチルガラクトサミンとタンパク質の断片がつながった糖ペプチド)を菌体内に取り込む ③α-N -アセチルガラクトサミニダーゼ(NagBb)によって糖とタンパクに分解される ④糖はさらに代謝されエネルギーとして利用される
(拡大画像↗)
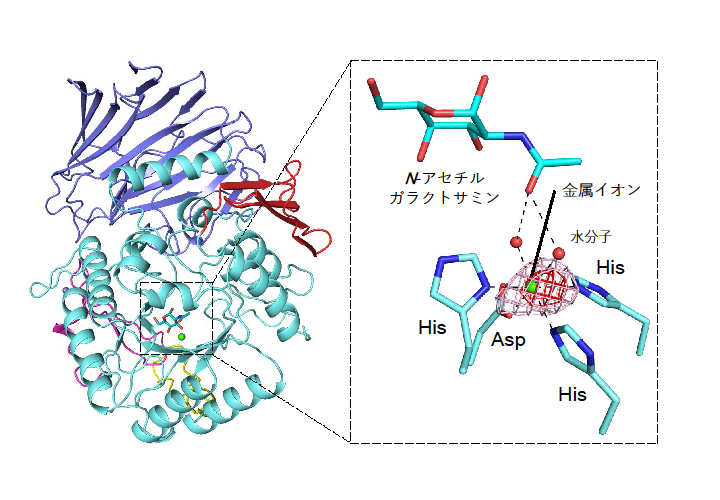
図2 α-N -アセチルガラクトサミニダーゼ(NagBb)の全体構造(左)と活性中心の構造(右)
基質の糖(N-アセチルガラクトサミン)の認識には、ヒスチジン(His)、アスパラギン酸(Asp)、水分子(赤の球)によって保持された金属イオン(緑の球)が関わっている。BL-1Aを利用して得られたカルシウム原子の異常分散効果を、赤とピンクの網目で表している。
(拡大画像↗)
ビフィズス菌はヒトの腸内に共生し、ヒトの健康に有用な善玉菌、プロバイオティクス(注3)として注目されている微生物です。ビフィズス菌は、栄養源が乏しい消化管の下部に生息するため、ヒトも他の菌も利用できないような分解しにくい構造を持つ難消化性の糖質や食物繊維などを分解して利用するためのユニークな仕組みを有することが知られています。例えば、母乳栄養児ではビフィズス菌が腸内で優勢になることが知られていますが、これも、他の菌が利用できない構造を持つオリゴ糖を、ビフィズス菌が分解して栄養源として利用するための機構を持っているために起こりうることです。近年、ビフィズス菌はヒトの腸管粘膜の上皮にある糖タンパク質(ムチン)の糖鎖もエネルギー源として生育に利用できることが明らかになってきました(図1)。ムチンに結合している糖鎖は様々な複雑な構造を持ちますが、タンパクと結合する根元の部分は、N-アセチルガラクトサミン(GalNAc)という糖がタンパク質中のセリン(Ser)またはスレオニン(Thr)にα-O-グリコシド結合した構造(GalNAcα1-O-Ser/Thr)となっています。
芦田久教授と伏信進矢教授らの研究グループは、以前より、ヒトの糖鎖をビフィズス菌が利用する仕組みに関する研究を行っていました。今回の研究では特に、ムチン糖鎖の根元において、糖であるN-アセチルガラクトサミンとタンパク質の間の結合を切断する酵素「α-N -アセチルガラクトサミニダーゼ(NagBb)」に着目して研究を行いました。そして、α-N -アセチルガラクトサミニダーゼの立体構造をX線結晶構造解析(注4)により世界で初めて明らかにすることに成功しました(図2左)。α-N -アセチルガラクトサミニダーゼは糖質加水分解酵素(注5)のファミリー129番に属しており、今回、初めてこのファミリーの酵素の立体構造が解き明かされたことになります。構造決定に際しては、高エネルギー加速器研究機構物質構造科学研究所の千田俊哉教授らのグループと共同研究を行い、S-SAD法という手法が用いられました。S-SAD法では、タンパク質(酵素)を構成するアミノ酸に含まれる硫黄原子の異常分散効果(注6)を構造決定に利用するため、通常の構造生物学用放射光実験施設では利用できない、長波長領域(波長約0.3ナノメートル、1ナノメートルは100分の1ミリメートル)の高輝度のX線ビームが必要となります。本研究では、同研究所が独自に設計・開発した高性能なビームライン(実験施設)であるBL-1AをX線データの測定に用いました。
α-N -アセチルガラクトサミニダーゼの全体構造や反応中心の構造は、ビフィズス菌が持つ他のファミリーの酵素と部分的に似ていました。一方で、その活性中心には、糖基質であるN-アセチルガラクトサミンの認識に金属イオンが関与しており、この金属が反応において非常に重要であることが明らかになりました(図2右)。このような基質認識の機構は糖質加水分解酵素においては初めての報告となります。また、この金属は、BL-1Aでの長波長X線を用いた測定実験によってカルシウムイオンであることが推定されました。
今回、α-N -アセチルガラクトサミニダーゼの立体構造を解明することにより、ビフィズス菌が腸内の糖鎖を利用して定着・増殖する仕組みがより明確になりました。また、ビフィズス菌由来の他のファミリーの酵素との関連や相違点、そして特徴的な金属の関与する反応機構が明らかになったことから、ビフィズス菌はヒトとの共生の過程でこのようなユニークな酵素を進化させてきたことが示唆されます。本研究は、ヒトと腸内細菌に関する研究において重要な知見を提供しただけでなく、今後、新たなプレバイオティクスの開発につながることも期待されます。
発表雑誌
- 雑誌名
- :「The Journal of Biological Chemistry」(掲載日:2017年5月25日)
- 論文タイトル
- :The First Crystal Structure of a Family 129 Glycoside Hydrolase from a Probiotic Bacterium Reveals Critical Residues and Metal Co-factors
- 著者
- :Mayo Sato, Dorothee Liebschner, Yusuke Yamada, Naohiro Matsugaki, Takatoshi Arakawa, Siobhán S. Wills, Mitchell Hattie, Keith A. Stubbs, Tasuku Ito, Toshiya Senda, Hisashi Ashida, and Shinya Fushinobu*
- DOI番号
- :10.1074/jbc.M117.777391
- 論文URL
- :http://www.jbc.org/content/early/2017/05/25/jbc.M117.777391
問い合わせ先
- 東京大学大学院農学生命科学研究科応用生命工学専攻 酵素学研究室
教授 伏信 進矢(ふしのぶ しんや) - Tel:03-5841-5151
Fax:03-5841-5151
研究室URL: http://enzyme13.bt.a.u-tokyo.ac.jp/
用語解説
- 注1 ビフィズス菌
- 主にヒトなどの動物の腸内の小腸下部から大腸にかけて生息する細菌で、いわゆる善玉菌と呼ばれる。特に乳児期に多く、母乳で育てた場合、全腸内細菌の90%以上を占めることもある。
- 注2 ムチン
- 腸管内の上皮組織を覆う粘性物質で、アポムチンと呼ばれるコアタンパク質が、多数の糖鎖によって修飾されている糖タンパク質。
- 注3 プロバイオティクスとプレバイオティクス
- プロバイオティクスとは、腸内フローラのバランスを改善することによって宿主の健康に好影響を与える生きた微生物であり、プレバイオティクスとは腸内の特定の細菌の増殖および活性を変化させることにより宿主に好影響を与え、健康を改善する難消化性食品成分である。前者の例として乳酸菌やビフィズス菌、後者の例として各種のオリゴ糖が挙げられる。
- 注4 X線結晶構造解析
- 酵素を含むタンパク質の立体構造を明らかにするための最も一般的な解析方法の一つ。目的物質の結晶にX線を照射し、回折データを測定することにより、微細な三次元構造を知ることができる。
- 注5 糖質加水分解酵素
- アミラーゼ、セルラーゼなど、糖質のグリコシド結合に作用して加水分解する酵素の総称でGlycoside Hydrolaseと呼ばれる。フランスのHenrissatらによりファミリー分類がなされており(http://www.cazy.org/)、Glycoside Hydrolaseのファミリーは現在1番から145番まで知られている。
- 注6 異常分散効果
- 原子に入射するX線の波長に依存して、その構成原子に固有の波長で散乱の強さが大きく変化する効果(異常散乱効果ともいう)。