“性”と“死”は隣り合わせ?
―交尾相手と天敵を嗅ぎ分ける神経回路の構造―
- 発表者
-
石井 健太郎(東京大学大学院農学生命科学研究科 応用生命化学専攻 博士課程)
小坂田 拓哉(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任研究員)
森 裕美 (東京大学大学院農学生命科学研究科 応用生命化学専攻/JST ERATO東原化学感覚シグナルプロジェクト
学術支援専門職員)
宮坂 信彦(理化学研究所 脳科学総合研究センター シナプス分子機構研究チーム 副チームリーダー)
吉原 良浩(理化学研究所 脳科学総合研究センター シナプス分子機構研究チーム シニアチームリーダー/
JST ERATO東原化学感覚シグナルプロジェクト グループリーダー)
宮道 和成(東京大学大学院農学生命科学研究科 応用生命化学専攻 特任准教授/
JST ERATO東原化学感覚シグナルプロジェクト グループリーダー)
東原 和成(東京大学大学院農学生命科学研究科 応用生命化学専攻 教授/
JST ERATO東原化学感覚シグナルプロジェクト 研究総括)
発表のポイント
◆雌マウスの性行動を促進する雄フェロモンESP1 (*1) の情報を処理する専用の神経回路の構造と機能を、これまでにない細胞レベルで明らかにしました。
◆ESP1の機能には雌雄差があります。扁桃体という脳領域が性別によってESP1シグナルの伝わり方を変えるスイッチの役割を果たすことを発見しました。
◆マウスの天敵であるヘビ由来のシグナルとESP1は同じ脳領域を活性化させますが、詳しく見るとそれぞれ専用の神経細胞を使って情報処理されることが分かりました。
発表概要
マウスは性行動や攻撃行動、天敵からの忌避行動といった様々な本能的な行動の制御に、匂いやフェロモンなどの化学感覚シグナルを利用しています。しかし、特定の化学感覚シグナルの入力が適切な行動出力へと変換される脳内の神経基盤は明らかになっていませんでした。雄マウスの涙液に分泌される約7 kDaのペプチドESP1は、雌マウスに対しては性行動促進、他の雄マウスに対しては攻撃行動促進の作用が見られます。東京大学大学院農学生命科学研究科/JST ERATO 東原化学感覚シグナルプロジェクトの宮道 和成特任准教授、東原 和成教授らの研究グループは、ESP1による雌マウスでの性行動促進に関わる神経回路について、細胞レベルでその構造と機能を明らかにしました。その過程において、扁桃体という脳の一部の領域がESP1シグナルの伝わり方を性別によって変えるスイッチの役割を果たすことを発見しました。また、マウスの天敵であるヘビ由来のシグナルとESP1が脳内の同一領域を活性化することが知られていましたが、細胞レベルではそれぞれ専用の神経細胞を使って情報処理されることが分かりました。“性”行動の相手となる雄マウス由来のシグナルと、自然界で遭遇した際には個体の“ 死” に直結する天敵からのシグナルには、それぞれ専用の神経回路が割り当てられるという今回の発見は、本能的な行動を制御する神経基盤のモデルを提供するものです。
発表内容
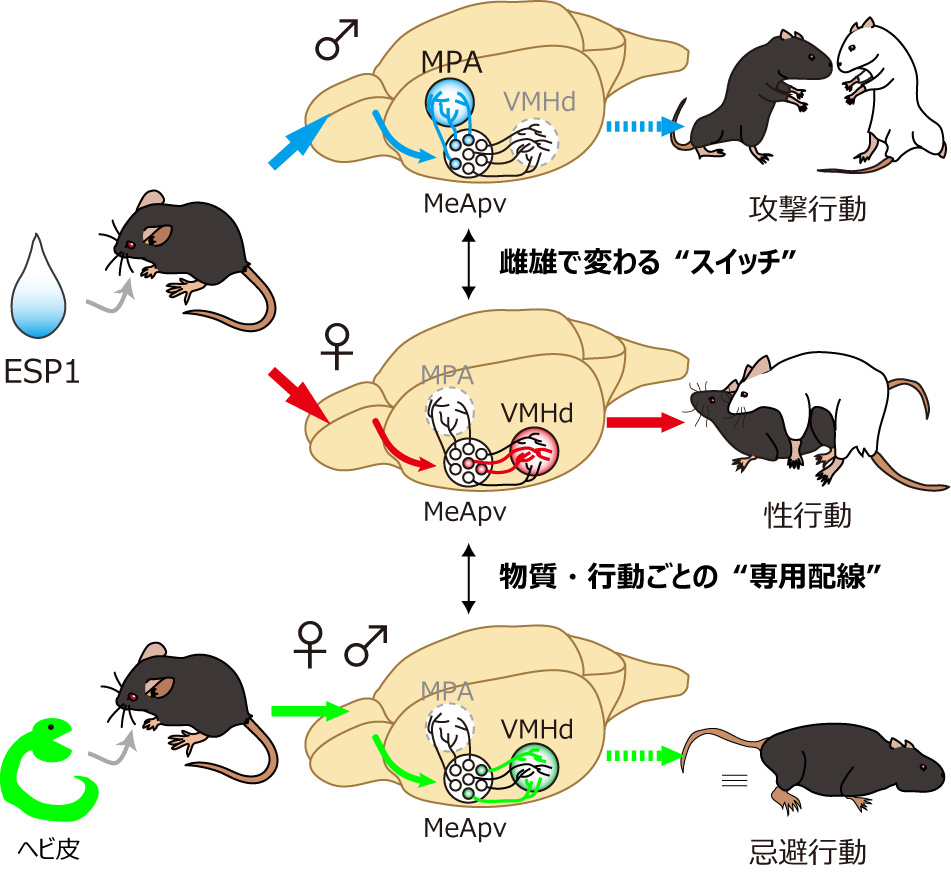
図 特定の化学感覚シグナルが個体の本能的な行動を変化させるための神経基盤
ESP1は雌マウスに受容されると性行動の促進を促進させる(中段)。本研究は、この際に用いられる神経回路を明らかにした。さらに、ESP1は雄マウスに受容されると攻撃行動を促進させる(上段)。MeApvという脳領域は “スイッチ” のように、ESP1の情報を雌雄で異なる下流の脳領域(MPAとVMHd)へと伝達し分けることが分かった。
一方で、マウスは天敵であるヘビの皮のシグナルを受容すると、忌避行動を引き起こす(下段)。ESP1とは異なる神経回路が用いられ、末梢の受容体から脳神経回路まで、それぞれの物質に“専用配線”が存在することが分かった。
(拡大画像↗)
生物は、外界からの様々なシグナルを感知し、それに基づく対応する行動を起こすかどうかを判断します。多くの場合、このプロセスには学習が必要ですが、中には学習を必要としない、特定の本能的な行動を引き起こすシグナルもあります。例えばマウスにおいて、異性や同性、天敵由来の化学感覚シグナル (匂いやフェロモンなど) は、性行動や攻撃行動、忌避行動をそれぞれ引き起こすことが分かっています。では、特定の化学感覚の入力を受けた適切な行動出力の選択は、どのような神経基盤によるものでしょうか。この疑問を解決するためには、末梢の受容器官から行動を引き起こす脳の中枢に至るまでの、化学感覚シグナルの情報が伝達される神経回路を詳細に明らかにすることが必要でした。しかし、動物の行動を制御する化学感覚シグナルの多くは、多様な脳領域を活性化させる混合物なので、これまでその基盤となる神経回路の解析が困難でした。本研究グループは、それだけで一種類の受容体を介して行動に影響を与えるESP1というフェロモンに着目することで、このフェロモン情報を処理する専用の神経回路について、その構造と機能を細胞レベルで明らかにしました。
ESP1は成熟した雄マウスの涙液中に分泌されるフェロモンです。雌マウスがESP1を受容すると、雄との交尾を受け入れる姿勢であるロードシス反射を示す頻度が上昇します。また、雄マウスがESP1を自分とは異なる系統の雄マウスの尿と同時に受容すると、攻撃行動が促進されることも分かっていました。ESP1は鋤鼻器官(*2)に発現するV2Rp5という単一種類の鋤鼻受容体によって受容されます。その後、末梢の細胞で受け取られた情報は、様々な脳領域に分布する神経細胞群を経て、行動の制御に深く関わる脳の中枢の神経細胞へと、順々に伝達されていきます。本研究では、その伝達されていく様子を、感染した神経細胞を起点に、その細胞から情報を受け取る下流の細胞へと伝染していく性質を持った順向性ウイルストレーサー(*3)を用いることで明らかにしました。順向性ウイルストレーサーをV2Rp5発現細胞に感染させることで、その下流に位置する中枢の神経回路を可視化しました。その結果、V2Rp5発現細胞から扁桃体や視床下部といった情動や行動を制御する脳領域に情報が伝達される順序が明らかとなりました。次に、V2Rp5の下流として同定された脳領域において、薬理遺伝学(*4)を用いて、その領域のみを阻害することで、ESP1による雌マウスの性行動促進作用に必要な領域を探索しました。その結果、扁桃体の中でも鋤鼻器官からの情報をよく受け取る内側扁桃体という脳領域の後腹部(MeApv)の必要性が明らかになりました。
さらに詳細な観察から、MeApvの中には特定の視床下部領域に偏って情報を伝達するタイプの神経細胞集団が存在することが分かりました。興味深いことに、ESP1の刺激によって雌マウスではMeApvから視床下部の腹内側核背側部(VMHd)へ情報を伝達するタイプの神経細胞が活性化されました。これに対して雄マウスでは、VMHdではなく視索前野(MPA)へ情報を伝達するタイプの神経細胞が活性化されていました。このように、MeApvはESP1の情報を受け取る際、シグナルを伝達するルートを性別により変更する“スイッチ”として機能することが分かりました。これは、ESP1が雌雄において異なる作用を持つための神経基盤と考えられ、性別による脳神経回路の機能的な差異を研究するための優れたモデルを提供するものです。
さて、雌マウスにおいてESP1の情報が伝達されることが明らかとなったMeApvからVMHdへの経路は、これまで忌避行動を引き起こす天敵のシグナルの伝達に深く関わっていることが知られていました。では、この一見すると同じ経路の中で、ESP1による性行動の促進と、天敵のシグナルによる忌避行動の促進は、どのように区別されて処理されているのでしょうか。本研究ではESP1とヘビの抜け殻 (天敵のシグナル) によって活性化される神経細胞の集団が異なることを示しました。次に、特定の化学感覚シグナルの刺激によって活性化される神経細胞のみを標識する手法(TRAP法*5)によって、ESP1に応答する神経細胞のみを操作する系を確立しました。これを用いてVMHdのESP1応答神経細胞を光遺伝学(*6)で活性化すると、あたかもESP1を受け取ったかのように雌マウスのロードシス反射が促進されました。この結果は、これまで忌避行動の中枢と思われていたVMHdの中に、雌の性行動を正に制御する神経細胞が別個の集団として存在することを示しています。すなわち “性”行動の相手となる雄マウス由来のシグナルと、自然界で遭遇した際には個体の“ 死” に直結する天敵からのシグナルは、隣り合う専用の神経細胞によって処理されています。このような特異的な構造が進化してきた理由や発生段階でどのように形成されるのかについては今後の研究が必要です。
一つの感覚シグナルに対して脳の”専用回線”が割り当てられているというしくみは、動物にとって重要な意味を持つ感覚シグナルが適切な行動出力へと変換されるのに好適です。今回の成果は、マウスの本能行動がどのように制御されているかの理解を深めるのみならず、本能行動に影響を与える様々な感覚シグナルを研究するための汎用的な方法論を提供するものです。加えて、雌の性行動を制御する脳神経回路に関する新たな知見は、中枢性の性機能障害を理解するための基礎的知見を提供するものです。
発表雑誌
- 雑誌名
- :「Neuron」
- 論文タイトル
- :A Labeled-Line Neural Circuit for Pheromone-Mediated Sexual Behaviors in Mice
- 著者
- :Kentaro K. Ishii*, Takuya Osakada*, Hiromi Mori, Nobuhiko Miyasaka, Yoshihiro Yoshihara, Kazunari Miyamichi*¶ and Kazushige Touhara¶
(* equally contribution; ¶ corresponding author)
- DOI番号
- :http://dx.doi.org/10.1016/j.neuron.2017.05.038
- 論文URL
- :http://www.sciencedirect.com/science/article/pii/S0896627317304762
問い合わせ先
- 東京大学大学院農学生命科学研究科 応用生命化学専攻 生物化学研究室
教授 東原 和成(トウハラ カズシゲ) - Tel:03-5841-5109
- Fax:03-5841-1304
- Email:ktouhara<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
- 研究室URL:http://park.itc.u-tokyo.ac.jp/biological-chemistry/
- 特任准教授 宮道 和成 (ミヤミチ カズナリ)
- Tel:03-5841-5112
- E-mail:amiyami<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
用語解説
- 注1 ESP1
- 成熟した雄マウスの涙に分泌されるタンパク質性の性フェロモンとして、2005年に発見された (Kimoto et al. Nature 2005)。外分泌腺から分泌されるExocrine gland-Secreting Peptide (ESP) ファミリーの一つである。雄マウスから分泌されるESP1 は、雌マウスの鋤鼻器官において単一の受容体V2Rp5を活性化させ、交尾受け入れ行動を促進する(Haga et al. Nature 2010)。さらに、雄マウスが他系統の雄マウスの尿ともに、ESP1を受容すると、攻撃行動が促進される(Hattori et al. Current Biology 2016)。
- 注2 鋤鼻器官
- 鼻腔下部に口吻側から尾側に向かって横たわるパイプ状の感覚器官。動物個体から分泌され
る低分子の有機化合物やペプチドおよびタンパク質を鋤鼻受容体で受容する。鋤鼻器官を外科的に切除したり、分子遺伝学的に機能を欠損させたりしたマウスの解析によって、鋤鼻器官は性行動などの社会行動に関わる化学感覚シグナルを受容することが強く示唆されている。 - 注3 順向性ウイルストレーサー
- 脳の中では、神経細胞同士がシナプスと呼ばれる構造を介して情報のやり取りを行い、大きな神経回路を形成する。神経細胞は極性を持つ、つまり、情報を受け取る部位と伝達する部位が分かれているため、神経細胞の集団で形成される神経回路には情報が伝達される“流れ”が生み出される。神経回路の中での情報の流れを解析するための手法として、ウイルストレーサーと呼ばれるツールが広く使われている。一般的に、ウイルストレーサーは神経細胞に感染して、その神経細胞が構成する神経回路を可視化することができる。本研究で用いたヘルペスウイルスを改変して作製されたウイルストレーサーは、感染した神経細胞から下流の神経細胞へ広がる性質(順向性)を持っている。従って狙った神経細胞を起点とし、その下流の神経回路を可視化することができる。
- 注4 薬理遺伝学
- 生体内には存在しない人工受容体を新たに特定の細胞に導入することで、その細胞の機能を薬剤で制御する手法。本研究では、ヒトムスカリン受容体を元に、生体内には存在しない化学物質であるclozapine-N-oxide (CNO)に活性化されるよう改変された人工受容体hM4Diを用いた。hM4DiはCNOを受容すると発現する神経細胞の活動を抑制することができる。
- 注5 TRAP法
- 特定の外部刺激によって活性化される神経細胞群を狙って人為的な制御を可能にする手法(Guenthner et al. Neuron 2013)。神経細胞の発火に伴って遺伝子発現が活性化されるArcタンパク質の制御領域の下流に、複合タンパク質CreERのコーディング領域が挿入された遺伝子改変マウスを用いる。CreERは組み換え酵素Creと改変型エストロゲン受容体ERT2を結合させた複合タンパク質で、ERT2と結合するタモキシフェンという薬剤の存在下でのみ、Creが細胞核内へ移行し組み換えを行うことができる。本研究では、Arc-CreERマウスにタモキシフェンを投与し、ESP1およびヘビ由来シグナルの刺激を行うことで、それぞれの物質によって活性化される神経細胞を人為的に制御した。
- 注6 光遺伝学
- 光受容タンパク質を特定の細胞に導入することで、その細胞の機能を光で制御することができる手法。本研究では、光感受性の非選択的な陽イオンチャネルであるChannel Rhodopsin 2(ChR2)を用いた。ChR2を発現する神経細胞に光を照射することで、人為的に狙った神経細胞の活性化を誘導することができる。