複数のドメインを持つタンパク質分子の動きをリアルタイムに直接観察する
- 発表者
- 原田 裕史(大阪大学大学院工学研究科応用化学専攻 博士課程学生)
小野田 晃(大阪大学大学院工学研究科応用化学専攻 准教授)
内橋 貴之(名古屋大学大学院理学研究科物質理学専攻 教授)
渡辺 大輝(名古屋大学大学院理学研究科物質理学専攻 研究員)
砂川 直輝(東京大学大学院農学生命科学研究科生物材料科学専攻 研究員)
鮫島 正浩(東京大学大学院農学生命科学研究科生物材料科学専攻 教授)
五十嵐 圭日子(東京大学大学院農学生命科学研究科生物材料科学専攻 准教授)
林 高史(大阪大学大学院工学研究科応用化学専攻 教授)
発表のポイント
◆きのこやカビなどの糸状菌によるバイオマス分解の鍵酵素であるセロビオース脱水素酵素から、補酵素の1つであるヘムを抜き取り、金の表面に固定化したヘムに入れ換えることで、シトクロムドメインだけを選択的に固定化しました。
◆基質の濃度を変えながら、酵素が固定化された金表面を高速原子間力顕微鏡で観察したところ、基質の添加とともにフラビンドメインがパタパタと動く様子が観察され、さらにその動きは基質濃度が高くなることで頻度が上がることが分かりました。
◆これまでX線結晶構造解析から推定されていた二つのドメインの動きを、分子レベルで直接観察することができ、様々な酵素の働きを明らかにすることができるようになります。
発表概要
大学院農学生命科学研究科生物材料科学専攻の五十嵐圭日子(きよひこ)准教授と砂川直輝研究員、鮫島正浩教授の研究チームは、大阪大学大学院工学研究科の原田裕史博士、小野田晃准教授、林高史教授の研究チームおよび名古屋大学大学院理学研究科の内橋貴之教授らの研究チームとの共同研究により、セロビオース脱水素酵素注1から補酵素の1つであるヘム注2を抜き取り、再構成させることに成功しました。補酵素を抜き取った酵素に新たに補酵素を入れる際に、金表面に固定化されたヘムを用いたところ、シトクロム注3ドメイン注4だけを選択的に金表面に固定化することに成功し、さらに高速原子間力顕微鏡注5によって、各ドメインの動きを分子レベルで観察することにも成功しました。本酵素の基質であるセロビオースの濃度を増加させながら金表面に固定化されたセロビオース脱水素酵素を高速原子間力顕微鏡で観察したところ、はじめは動かなかったフラビン注6ドメインが、セロビオースの添加とともにパタパタと動きはじめ(flip-flop motion)、濃度の増加とともにその頻度が高くなる様子が観察されました。セロビオース脱水素酵素は、きのこやカビなどの糸状菌がセルロース系バイオマスを酸化的に分解する時に使う重要な酵素であることが知られており、1990〜2000年代の生化学的解析や近年のX線結晶構造解析でも二つのドメインが閉じたり開いたりすることで電子伝達反応が起こると考えられていました。しかしながら、そのような動きを分子レベルでリアルタイムに観察したのは世界初です。自然界では、セロビオース脱水素酵素と同じように複数のドメインを持つ(マルチドメイン)酵素が数多く存在していますが、本手法はマルチドメイン酵素のダイナミックな動きを分子レベルで直接観察することを可能にすることから、本研究によってこのような酵素の機能解析が加速すると考えられます。
発表内容
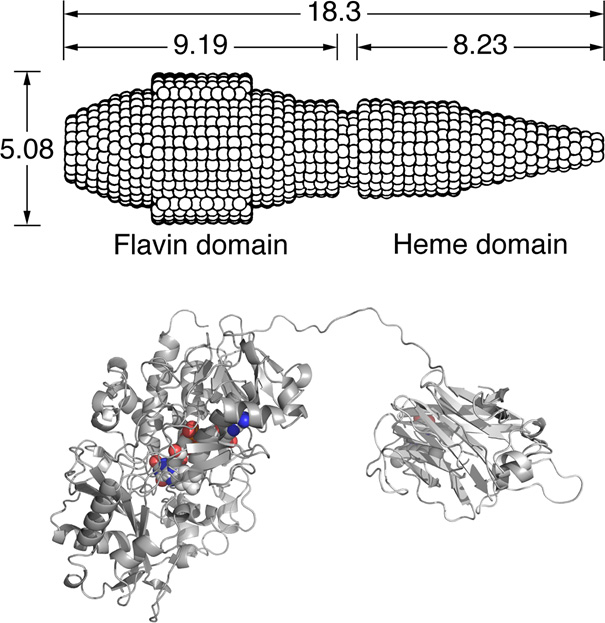
図1 小角X線散乱によって得られたセロビオース脱水素酵素の概形(上段、参考文献2)とX線結晶構造解析で得られた「開いた状態」の予想図(下段)
(拡大画像↗)
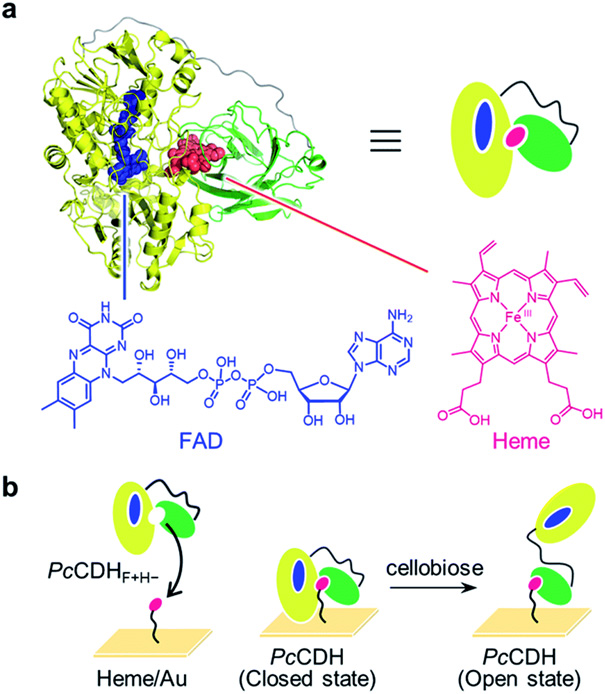
図2 (a)きのこの一種であるPhanerochaete chrysosporium由来セロビオース脱水素酵素の推定三次元構造とFADとヘム(Heme)の化学構造。(b)金表面に固定化されたヘムを用いたシトクロムドメインの固定化。
(拡大画像↗)

図3 高速原子間力顕微鏡(HS-AFM)で観察されたセロビオース脱水素酵素分子。基質であるセロビオースを入れていないとき(左)は酵素が動かないのに対して、150μMの基質を加えたとき(右)は分子が運動していることが分かる。
(拡大画像↗)
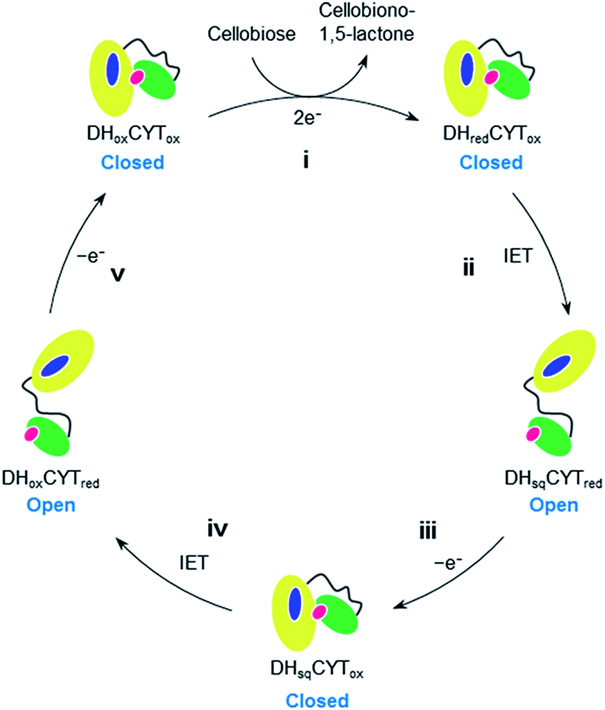
図4 セロビオース脱水素酵素の反応とそれに伴うフラビンドメインおよびシトクロムドメインの動き。(拡大画像↗)
タンパク質は、様々な機能を発現させるために複数のドメインが連なったマルチドメイン構造をとることがあります。2つ以上のドメインを組み合わせることで、個々のドメインだけでは持ち得ない新しい機能を付与することができるため、生物が多様な化学反応を使いこなすために進化の過程で獲得してきた戦略の一つだと考えられています。木材などのバイオマスを分解する「きのこ」のような生き物においても、セルラーゼをはじめとする様々な酵素においてこのようなマルチドメイン構造をとるものが見られます。
その中で、セルロースの分解に関与する酸化酵素として1970年代に単離された「セロビオース脱水素酵素」は、補酵素としてフラビンとヘムを含む2つのドメインからなる酵素で、フラビンドメインではセルラーゼによって切り出されてくるセロビオースを酸化する反応が起こり、その時に得られる電子がシトクロムドメインにあるヘムに受け渡される反応が起こります。その時の電子伝達機構に関しては、2005年に五十嵐准教授らが生化学的実験によって「電子伝達鎖反応(electron-chain reaction)」であることを明らかにしています参考文献1。しかしながら、1996年に小角X線散乱法注7で明らかになったセロビオース脱水素酵素の全体構造参考文献2は「ロケット」のような構造をしており(図1上段)、その全体構造に2000年代に明らかになったフラビンドメインとシトクロムドメインそれぞれのX線結晶構造をはめ込むと(図1下段)、フラビン−ヘム間の距離が電子伝達の限界と考えられている14Åを超えてしまうために、どのような機構で電子が運ばれるのかは長い間不明でした。
そのような中で、2015年にスウェーデンとオーストリアの共同研究チームは、カビが生産する2種類のセロビオース脱水素酵素のX線結晶構造解析に成功し参考文献3、それぞれ2つのドメインが「開いた状態(open conformation)」と「閉じた状態(closed conformation)」であることを明らかにしました。小角X線散乱で明らかになった全体構造が、そのうちの「開いた状態」と近かったことから、セロビオース脱水素酵素はフラビンドメインとシトクロムドメインがついたり離れたりすることで電子伝達を行うと考えられました。一方で、これらの結果は違う菌から得られた酵素の構造を比較したものであり、さらにX線結晶構造解析では動きが明らかにできないため、実際にセロビオース脱水素酵素の2つのドメインがついたり離れたりする直接的な証拠にはなりませんでした。
そこで五十嵐准教授らは大阪大学の林教授・小野田准教授、名古屋大学の内橋教授らとともに、セロビオース脱水素酵素の動きを分子レベルで直接観察する共同研究を開始しました。五十嵐准教授らと名古屋大学の内橋教授らとの長年の共同研究によって、高速原子間力顕微鏡を用いたタンパク質の一分子観察に成功していましたが、セロビオース脱水素酵素の場合はフラビンドメインとシトクロムドメインの大きさが近いため、高速原子間力顕微鏡の画像からどちらのドメインかを同定することは難しいと考えられました。そこで、林教授・小野田准教授のグループが開発したヘムの入れ換え法によって元々入っていたヘムを抜き、金表面に固定化したヘムに入れ換えることで、シトクロムドメインだけを金の表面に固定化しました(図2)。固定化されたセロビオース脱水素酵素を高速AFMで観察すると、15ナノメートル(ナノメートルは1ミリメートルの100万分の1)程度の高さを持つ粒子が観察されました(図3)が、これはちょうどセロビオース脱水素酵素が「開いた状態」の長さ方向と同じくらいでした。次にセロビオース脱水素酵素の基質であるセロビオースを添加したところ、ある数の酵素分子がパタパタと動く様子が観察されました。さらにより多くの基質を添加していくと動く分子の数が多くなりました。
今回の実験ではシトクロムドメインだけが金の表面に固定化されていること、加えた基質はフラビンドメインで酸化反応が行われること、さらにこれまでの生化学的な解析結果と比べ合わせることで、パタパタと動いているのがフラビンドメインであり、セロビオースを酸化し、電子伝達を行うためにシトクロムドメインとついたり離れたりしていることが証明されました(図4)。
自然界には様々なマルチドメイン構造を持つタンパク質が存在することから、あるドメインだけを固定化して高速原子間力顕微鏡によって各ドメインの機能を調べるという本実験手法は、これまで明らかにできなかったドメイン同士の動的な関係性(インタラクション)を調べるために有効な手段となります。
本研究の一部は、文部科学省科学研究費補助金新学術領域研究「元素ブロック高分子材料の創出」(領域代表:京都大学 中條善樹 教授、公募研究分担者:小野田晃)、「高難度物質変換反応の開発を指向した精密制御反応場の創出」(領域代表:大阪大学 真島和志 教授、計画研究代表者:林高史)、「生命分子システムにおける動的秩序形成と高次機能発現」(領域代表:岡崎統合バイオサイエンスセンター 加藤晃一 教授、公募研究代表者:内橋貴之)、「理論と実験の協奏による柔らかな分子系の機能の科学」(領域代表:理化学研究所 田原太平 主任研究員、公募研究代表者:内橋貴之)「植物細胞壁の情報処理システム」(領域代表:東北大学 西谷和彦 教授、計画研究代表者:五十嵐圭日子)、大阪大学「生体統御ネットワーク医学教育プログラム」(原田裕史)、旭硝子財団研究助成(五十嵐圭日子)の補助を受けたものです。
参考文献
- Igarashi, K., Yoshida, M., Matsumura, H., Nakamura, N., Ohno, H., Samejima, M., and Nishino, T., Electron transfer chain reaction of the extracellular flavocytochrome cellobiose dehydrogenase from the basidiomycete Phanerochaete chrysosporium, FEBS J. 272: 2869-2877 (2005)
- Lehner, D., Zipper, P., Henriksson, G., and Pettersson, G., Small-angle X-ray scattering studies on cellobiose dehydrogenase from Phanerochaete chrysosporium, Biochim. Biophys. Acta. 1293: 161-169 (1996)
- Tan, T. C., Kracher, D., Gandini, R., Sygmund, C., Kittl, R., Haltrich, D., Hällberg, B. M., Ludwig, R., and Divne, C., Structural basis for cellobiose dehydrogenase action during oxidative cellulose degradation, Nature Commun. 6: 7542 (2015)
発表雑誌
- 雑誌名
- :「Chemical Science」8巻6561 – 6565頁(オンライン版の場合:8月3日)
- 論文タイトル
- :Interdomain flip-flop motion visualized in flavocytochrome cellobiose dehydrogenase using high-speed atomic force microscopy during catalysis
- 著者
- :Hirofumi Harada、†Akira Onoda, †Takayuki Uchihashi、Hiroki Watanabe, Naoki Sunagawa、Masahiro Samejima、†Kiyohiko Igarashi and †Takashi Hayashi
†責任著者 - DOI番号
- :10.1039/C7SC01672G
- 論文URL
- :https://doi.org/10.1039/C7SC01672G
問い合わせ先
- 東京大学 大学院農学生命科学研究科 生物材料科学専攻 森林化学研究室
准教授 五十嵐 圭日子(いがらし きよひこ) - Tel:03-5841-5258
- Fax:03-5841-5273
- Email: aquarius <at>mail.ecc.u-tokyo.ac.jp <at>を@に変えてください。
用語解説
- 注1 セロビオース脱水素酵素
- きのこやカビがバイオマスを分解する際に生産する酸化還元酵素の一種で、セルロースがセルラーゼによって分解されたときにできるセロビオース(グルコースがβ−1,4結合した二糖)の還元性末端を酸化する酵素。
- 注2 ヘム
- 鉄原子とポルフィリンと呼ばれる有機化合物が錯体を形成したもので、生体内で様々な酸化還元反応を司っています。ヘモグロビンのように酸素分子の運搬に関与したり、ペルオキシダーゼのように化学反応を行ったりすることができます。セロビオース脱水素酵素では、b型のヘムがシトクロムドメイン中に含まれており、FADから電子を受け取ってその他の化合物に電子を流す役割を担っています。
- 注3 シトクロム
- 酸化還元能を有するヘムタンパク質の総称です。呼吸鎖での電子伝達の重要な役割を担い、生体のエネルギー生産に関わっています。セロビオース脱水素酵素では一部がシトクロムドメインとして電子伝達に関わる重要な機能を果たしています。
- 注4 ドメイン
- タンパク質の中である程度の大きさをもつ「かたまり」になっている領域のことで、多くの場合はα−ヘリックスやβ−シートなどの二次構造が集まって1つの機能領域となっている部分をさします。セロビオース脱水素酵素の場合はフラビンとヘムをそれぞれ補酵素として含む2つのドメインがつながって1つの分子を形成しています。
- 注5 高速原子間力顕微鏡(High-Speed Atomic Force Microscopy, HS-AFM)
- 既存の原子間力顕微鏡のイメージング速度を超高速化することで、リアルタイムにナノメートルの分解能で物質の動態を観察することに成功した最新の顕微鏡。タンパク質をはじめとする生体分子の動的な振る舞いをリアルタイムで撮影することができます。
- 注6 フラビン
- ジメチルイソアロキサジンを骨格として持つ一連の化合物のこと。一般的にビタミンB2として知られるリボフラビンや、補酵素のフラビンモノヌクレオチド(FMN)、フラビンアデニンジヌクレオチド(FAD)などがあります。セロビオース脱水素酵素はFADを使ってセロビオースを酸化することが知られています。
- 注7 小角X線散乱法
- タンパク質の溶液に照射して得られるX線散乱のうち散乱角が小さいものを測定することで、タンパク質分子などの全体構造を調べる際に用いられる手法。セロビオース脱水素酵素の概形は本手法によって図1のようなロケット型であることが長年知られていました。